
【题目】我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)______________。
(2)______________。
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是

A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
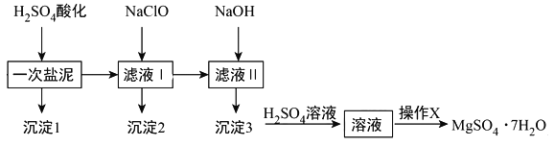
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和___________、____________.
(2)“操作X”是将溶液____________、____________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为_________________________________.
(4)检验滤液Ⅱ中是否含有Fe3+的实验方法是__________________________.
(5)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:

下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B. 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C. 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆)
D. 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)这四种溶液中水的电离程度由大到小的顺序是___________________(用序号填写)。
(2)等体积混合③和④的溶液中离子浓度的大小顺序是:__________________________。
(3)②溶液中存在的质子守恒关系:c(OH-)=___________________________。
(4)向④中加入少量氯化铵固体,溶液中c(H+)______(填“增大”、“减小”或“不变”)
(5)取10mL溶液③,加水稀释到100mL,则该溶液中由水电离出的c(H+)约为________。
Ⅱ.普通泡沫灭火器内的玻璃筒里盛有Al2(SO4)3溶液,铁筒中盛有NaHCO3溶液,当意外失火时,打开泡沫灭火器使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:______________________________________,不能把Al2(SO4)3溶液盛放在铁筒中的主要原因是______________________________________________________。
Ⅲ.某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是___________________,调pH的最适宜范围为__________。
(2)调pH过程中加入的试剂最好是___________(填标号)。
A. NaOH B. CuO C.NH3·H2O D.HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com