
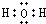 和
和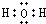 .
.分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素;
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;
(2)QX为NaH,NaH为离子化合物;NaH与水反应生成氢氧化钠和氢气;
(3)X为H、Z为O,二者形成的两种化合物为水、双氧水;
(4)①若上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,D是淡黄色固体,D为Na2O2,
②如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,A与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠,据此进行解答.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(2)QX为NaH,NaH为离子化合物,其电子式为:Na+[:H]-;NaH与水反应生成氢氧化钠和氢气,反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:Na+[:H]-;NaH+H2O=NaOH+H2↑;
(3)X为H、Z为O,二者形成的两种化合物为水、双氧水,其电子式分别为: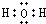 、
、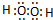 ,
,
故答案为: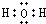 ;
;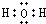 ;
;
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系A$?_{D}^{C}$B(在水溶液中进行),其中,C是溶于水显酸性的气体,则C为CO2,D是淡黄色固体则D为Na2O2,则:
①二氧化碳中存在两个碳氧双键,CO2的结构式为O=C=O,
故答案为:O=C=O;
②如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,甲与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生灵活应用基础知识的能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
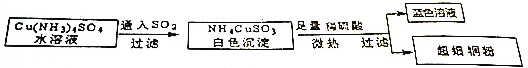
| A. | SO2在此过程中作氧化剂 | |
| B. | 超细铜粉能导电,所以超细铜粉是电解质 | |
| C. | 工业上常用电解法冶炼铜 | |
| D. | 理论上制得1mol铜粉,共转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 带相反电荷离子之间的相互吸引称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属原子间不可能形成离子键,存在离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
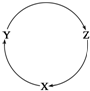 下列各组物质中,不能满足下图物质一步转化关系的选项是( )
下列各组物质中,不能满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NaOH | Na2CO3 | NaHCO3 |
| B | C | CO | CO2 |
| C | Cu | CuSO4 | Cu(OH)2 |
| D | AlCl3 | NaAlO2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
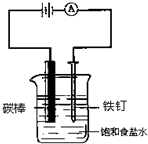
| A. | 碳酸镁 | B. | 硫酸钡 | C. | 氢氧化镁 | D. | 碳酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据置换反应Na+KCl$\frac{\underline{\;高温\;}}{\;}$NaCl+K↑,推出金属Na的活泼性强于金属K的活泼性 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据金属活动顺序表推知Sn活泼性强于Pb,推出碱性Sn(OH)4>Pb(OH)4 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
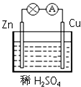
| A. | H2-2e-═2H+ | B. | Cu-2e-═Cu2+ | C. | 2H++2e-═H2↑ | D. | Zn-2e-═Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com