
已知化学反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)⇌FeO(s)+H2(g),其平衡常数为K2.在温度973K 和1173K 情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是 吸热 (填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)⇌CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 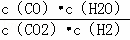 .
.
(3)能判断反应③已达平衡状态的是 BC .
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式 K3=K1•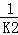 .据此关系式及上表数据,也能推断出反应③是 吸热 (填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 DF (填写序号).
.据此关系式及上表数据,也能推断出反应③是 吸热 (填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 DF (填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度 E.使用合适的催化剂 F.设法减少CO的量.
| 吸热反应和放热反应;化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据温度升高平衡常数的变化判断; (2)依据平衡常数概念写出反应的平衡常数计算式; (3)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断; (4)利用盖斯定律计算,平衡常数,结合图表中平衡常数随温度变化分析反应热量变化;依据化学平衡影响因素分析平衡移动方向. |
| 解答: | 解:(1)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热, 故答案为:吸热; (2)依据反应CO2(g)+H2(g)=CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K= (3)A、此反应是个气体体积不变的反应,故无论平衡与否,容器中压强一直不变,故压强不变不能作为反应达平衡的标志,故A错误; B、混合气体中c(CO)不变,说明CO的消耗速率和生成速率相等,即正逆反应速率相等,故反应平衡,故B正确; C、H2的正反应速率与H2O的逆反应速率相等,表示的是正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C正确; D、C(CO2)=C(CH3OH),不能判断正逆反应速率是否相等,无法判断是否达到平衡状态,故D错误; 故选BC. (4)已知:①Fe(s)+CO2(g)⇌FeO(s)+CO(g); ②Fe(s)+H2O(g)⇌FeO(s)+H2(g); 利用盖斯定律将①﹣②可得:③H2(g)+CO2(g)⇌CO(g)+H2O(g); 则K3= 依据图表平衡常数数据分析,温度升高 ③H2(g)+CO2(g)⇌CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则 A.缩小反应容器容积实质增大压强,反应前后气体体积不变,平衡不动; 故A不符合; B.扩大反应容器容积,压强减小,反应前后气体体积不变,平衡不动;故B不符合; C.反应是吸热反应,降低温度,平衡向放热反应方向进行,平衡逆向进行,故C不符合; D.反应是吸热反应,升高温度,平衡向吸热反应方向进行,平衡正向进行,故D符合; E.使用合适的催化剂,催化剂只改变反应速率,不改变平衡,故E不符合; F.设法减少CO的浓度,减少生成物浓度平衡正向进行,故F符合; 故答案为: |
| 点评: | 本题考查化学平衡影响因素的分析判断,平衡常数的计算应用,数据处理的能力,题目难度中等. |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是
A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
B、核外电子排布相同的微粒化学性质也相同 |
C、Cl-、S2-、Na+、K+半径逐渐减小 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 1mol·L-1NaCl溶液含有NA个Na+离子
B. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
C. 盛有CO2的密闭容器中含有NA个氧原子,则CO2的物质的量不一定是0.5mol
D. 常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2A(g)⇌2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
|
| A. | 加压 | B. | 减压 | C. | 减小E的浓度 | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2⇌PCl5,各物质均为气态.达平衡后,PCl5为0.4mol.若此时再加入1molPCl3 和0.5molCl2,相同温度下达到平衡,PCl5的物质的量为x( )
|
| A. | 0.4mol | B. | 0.6mol | C. | 0.4<x<0.6mol | D. | x>0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是 ( )B
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且密度必须比水大
D.不溶于水,且密度必须比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在水溶液中能大量共存的是 ( )
A.Na+、Ba2+、Cl-、SO42- B. Ca2+、HCO3-、Cl-、K+
C.Mg2+、Ag+、NO3-、Cl- D. H+ 、Cl- 、Na+ 、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.5g铁铝混合物粉末加入900mL1mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。(填“是”或“否”)
(2)若a=3.36L(标况),则混合物中铝的质量分数为_______。(保留到小数点后一位)
(3)若a=3.36L(标况):要使沉淀的量不随NaOH溶液量的变化而变化,往上述反应后的溶液中至少需要加入_______mL1mol/L NaOH溶液;要使生成的沉淀量最大,往上述反应后的溶液中需要加入_____mL1mol/L NaOH溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com