
 Cu +H2O
Cu +H2O 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O| A£®ŹĒŃõ»Æ¼Į |
| B£®ŹĒ»¹Ō¼Į |
| C£®¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į |
| D£®¼Č²»ŹĒŃõ»Æ¼ĮÓÖ²»ŹĒ»¹Ō¼Į |
 Cu +H2Oøł¾Ż·“Ó¦æÉÖŖ£¬HŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬CuŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬¹Ź±»Ńõ»ÆµÄŌŖĖŲĪŖHŌŖĖŲ”££Ø3£©¢óĒųÓņĪŖŃõ»Æ»¹Ō·“Ó¦£¬ĒŅ²»ŹōÓŚÖĆ»»”¢»ÆŗĻ”¢·Ö½ā·“Ó¦£¬¹Ź¢Ü·ūŗĻĢāŅā”££Ø4£©¢õĒųÓņĪŖø“·Ö½ā·“Ó¦£¬ĒŅÓŠ³Įµķ£¬Ė®Éś³É”£H2CO3+Ca2++2OH-=CaCO3+2H2O
Cu +H2Oøł¾Ż·“Ó¦æÉÖŖ£¬HŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬CuŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬¹Ź±»Ńõ»ÆµÄŌŖĖŲĪŖHŌŖĖŲ”££Ø3£©¢óĒųÓņĪŖŃõ»Æ»¹Ō·“Ó¦£¬ĒŅ²»ŹōÓŚÖĆ»»”¢»ÆŗĻ”¢·Ö½ā·“Ó¦£¬¹Ź¢Ü·ūŗĻĢāŅā”££Ø4£©¢õĒųÓņĪŖø“·Ö½ā·“Ó¦£¬ĒŅÓŠ³Įµķ£¬Ė®Éś³É”£H2CO3+Ca2++2OH-=CaCO3+2H2O


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 H2SO3 + OHØC ŗĶ ¢Ś £ØŠ“³öĄė×Ó·½³ĢŹ½£©
H2SO3 + OHØC ŗĶ ¢Ś £ØŠ“³öĄė×Ó·½³ĢŹ½£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®ĮņĄė×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ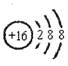 |
B£®·ś»ÆĆ¾µÄµē×ÓŹ½£ŗ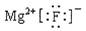 |
| C£®øŹ°±ĖįµÄ½į¹¹Ź½£ŗC2H5O2N |
| D£®ĒāŃõ»Æ±µµÄµēĄė·½³ĢŹ½£ŗBa(OH)2£½Ba2++(OH)22- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ4NH3£«3F2”ś NF3£«3NH4F |
| B£®MŹĒ¼«ŠŌ·Ö×Ó£¬Ę仹ŌŠŌ±ČNH3Ēæ |
| C£®M¼ČŹĒŃõ»Æ²śĪļ£¬ÓÖŹĒ»¹Ō²śĪļ |
| D£®NÖŠ¼Čŗ¬ÓŠĄė×Ó¼ü£¬ÓÖŗ¬ÓŠ¹²¼Ū¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 HSO3 -+H+ K=1.5”Į10-2
HSO3 -+H+ K=1.5”Į10-2 HCO3 -+H+ K=4.4”Į10-7
HCO3 -+H+ K=4.4”Į10-7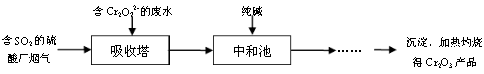
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
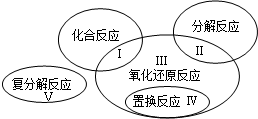
| A£®»ÆŗĻ·“Ó¦ | B£®ÖĆ»»·“Ó¦”””” | C£®·Ö½ā·“Ó¦ | D£®ø“·Ö½ā·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®SO2”śH2SO3 | B£®Cl2”śNaClO | C£®Fe”śFeCl2 | D£®HNO3”śO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
| ±ąŗÅ | ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč¢Ł | ȔɣĮæ“ż²āŅŗ¼ÓČėŹŌ¹ÜÖŠ£¬¼ÓČė¹żĮæ2mol”¤L-1HCl£¬ŌŁµĪ¼ÓŹŹĮæ1 mol”¤L-1BaCl2 ČÜŅŗ”£ | ÓŠ°×É«³ĮµķÉś³É£¬Ö¤Ć÷“ż²āŅŗÖŠŗ¬ÓŠ”¢SO42- ”£ |
| ²½Öč¢Ś | | |
| ²½Öč¢Ū | | |
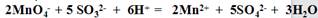
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ÕįĢĒÓė“×ĖįµÄ×ī¼ņŹ½ĻąĶ¬ |
| B£®16OÓė18O»„ĪŖĶ¬Ī»ĖŲ£¬H216O”¢D216O”¢H218O”¢D218O»„ĪŖĶ¬ĖŲŅģŠĪĢå |
C£®SiH4”¢CH4”¢ Į£×ÓµÄæռ乹ŠĶĪŖÕżĖÄĆęĢåŠĶ£»CO2”¢C2H2¾łĪŖÖ±ĻߊĶ·Ö×Ó Į£×ÓµÄæռ乹ŠĶĪŖÕżĖÄĆęĢåŠĶ£»CO2”¢C2H2¾łĪŖÖ±ĻߊĶ·Ö×Ó |
D£®Ca2£«µÄ½į¹¹Ź¾ŅāĶ¼ĪŖ £»NH4ClµÄµē×ÓŹ½ĪŖ £»NH4ClµÄµē×ÓŹ½ĪŖ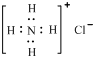 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com