
【题目】二氧化硫的污染臭名昭著,含硒的化学药物却有望迎来美名。某环保车间将含SO2、NO烟气经O3预处理后用CaSO3水悬浮液吸收。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)实验表明,在常温下反应:3NO(g)+O3(g)=3NO2(g)正向自发,试说明原因:_____。
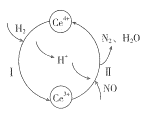
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示,试写出反应I的离子反应方程式:___________,反应II的离子方程式:________________。
(3)用CaSO3水悬浮液处理二氧化氮,若在吸收液中加入Na2SO4溶液,能提高NO2的吸收速率,其主要原因是___________;达到平衡后,溶液中c(SO32-)=__________[用c(SO42-、Ksp(CaSO3)和Ksp(CaSO4)表示]。
(4)氮的氧化物还可以通过电解法处理获得氮气和氧气,电解质为固体氧化物陶瓷,据图写出阴极的电极反应方程式:_______________。

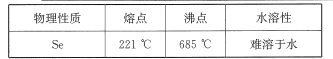
(5)已知 SeO2与SO2的混合烟气用水吸收可制得单质硒,过滤得粗硒,硒的部分物理性质如下表所示。某工艺采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_____。
(6)最近我国学者锁定COVID-19的新靶点Mpro蛋白酶,通过先进筛选手段,在FDA批准的已上市和临床实验药物中,发现老药Ebselen(![]() )在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________
)在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________![]() ,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。

【答案】反应的△H=-317.3 kJ·mol-1,该反应是气体体积减小的反应,△S小于零,但数值很小,在常温下,△G=△H-T△S<0,反应自发 2Ce4++H2=2Ce3++2H+ 4H++2NO+4Ce3+=N2+4Ce4++2H2O CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率 [Ksp(CaSO3)/Ksp(CaSO4)]×c(SO42-) 2NOx+4xe-=N2+2xO2- 降低Se的沸点,避免Se与空气中氧气发生反应 10 这类药物相当于病毒复制反应中的负催化剂,能明显的减缓反应速率,药物的有效特别强调催化剂的选择性,尽量不能影响人体健康
【解析】
(1)①NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1,②NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1,利用盖斯定律,由反应①+2×②得3NO(g)+O3(g)=3NO2(g) △H=-317.3 kJ·mol-1,该反应是气体体积减小的反应,△S<0,但是数值很小,在常温下,△G=△H-T△S<0,反应自发;
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,根据转化过程的图示可知反应I是H2还原Ce4+,其离子方程式为2Ce4++H2=2Ce3++2H+;反应II的离子方程式:4H++2NO+4Ce3+=N2+4Ce4++2H2O ;
(3)加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加速SO32-与NO2的反应速率, ,故溶液中c(SO32-)=[Ksp(CaSO3)/Ksp(CaSO4)]×c(SO42-);
,故溶液中c(SO32-)=[Ksp(CaSO3)/Ksp(CaSO4)]×c(SO42-);
(4)由题意可知NOx在阴极放电生成N2,电极反应式为2NOx+4xe-=N2+2xO2- ;
(5)真空使得压强降低,从而降低Se的沸点,避免Se与空气中氧气发生反应;
(6)由图b可知Ebselen浓度为10![]() 时出现拐点,且浓度再增大抑制率变化不大,故最佳浓度为10
时出现拐点,且浓度再增大抑制率变化不大,故最佳浓度为10![]() 。分析影响反应速率的因素,这类药物相当于病毒复制反应中的负催化剂,能明显的减缓反应速率,药物的有效特别强调催化剂的选择性,尽量不影响人体健康。
。分析影响反应速率的因素,这类药物相当于病毒复制反应中的负催化剂,能明显的减缓反应速率,药物的有效特别强调催化剂的选择性,尽量不影响人体健康。


科目:高中化学 来源: 题型:
【题目】(1)实验室制氯气的尾气处理用_____溶液吸收,其化学反应方程式为_____。
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为_____,后白色沉淀又溶解消失,其反应的离子方程式为_____。
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为_____(填NO或H2),你所选气体在标准状况下的体积为_____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是

已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的![]()
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是元素的摇篮,海水中含有大量卤族元素。NaCl晶胞结构示意图如下所示(晶胞边长为a nm).
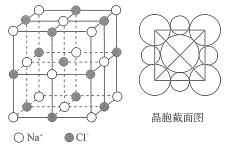
(1)元素 Na的价电子被激发到相邻高能级后形成的激发态Na原子,其价电子轨道表示式为__________。
(2)除了 NaCl,Cl 元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:__________。
(3)在适当条件下,电解NaCl水溶液可制得 NaClO3。
①NaCl水溶液中存在的微粒间作用力有________(填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
②根据价层电子对互斥理论,预测ClO3-的空间构型为________,写出一个ClO3-的等电子体的化学符号:______________
(4)在NaCl晶体中,Na 位于Cl 所围成的正______面体的体心,该多面体的边长是______nm。
(5)Na 半径与Cl半径的比值为______(保留小数点后3位,![]() =1.414)。
=1.414)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,前者小于后者的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+![]() O2(g)===H2O(l) ΔH2
O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ①②③ B. ②④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(NO3)3是一种重要的媒染剂和金属表面处理剂,易溶于水、乙醇,微溶于硝酸,具有较强的氧化性。某学习小组利用如图装置制备Fe(NO3)3并探究其性质。
回答下列问题:
步骤一:制备Fe(NO3)3
a中加入100mL8mol·L-1硝酸,b中加入5.6g铁屑,将硝酸与铁屑混合后水浴加热。
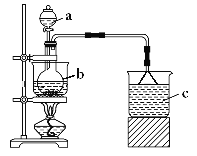
(1)仪器b的名称是___。
(2)反应过程中观察到b中铁屑溶解,溶液变黄色,液面上方有红棕色气体产生,仪器b中反应的离子方程式是___。
(3)c中所盛试剂是___,倒扣漏斗的作用是___。
(4)若要从反应后的溶液中得到Fe(NO3)3晶体,应采取的操作是:将溶液蒸发浓缩、冷却结晶、过滤、用____洗涤、干燥。
步骤二:探究Fe(NO3)3的性质
i.测得0.1mol·L-1Fe(NO3)3溶液的pH约等于1.6。
ii.将5mL0.1mol·L-1Fe(NO3)3溶液倒入有银镜的试管中,约1min后银镜完全溶解。
(5)使银镜溶解的原因可能有两个:a.NO3(H+)使银镜溶解;b.__使银镜溶解。为证明b成立,设计如下方案:取少量银镜溶解后的溶液于另一支试管中,___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com