
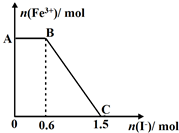
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
分析 氧化性强弱为:K2Cr2O7>Fe3+,由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:A.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为$\frac{1.5}{6}$mol=0.25mol,故A错误;
B.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故B正确;
C.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,正确的离子方程式为:2Fe3++2I-=2Fe2++I2,故C错误;
D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意明确发生的反应及电子守恒计算该题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 柠檬吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人体内各体液的pH总保持一定范围 | |
| C. | 通常富含蛋白质、脂肪和糖类的食物多为酸性食物 | |
| D. | 食物的酸碱性与化学上所指溶液的酸碱性是不同的概念 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 23g钠在化学反应中得到的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
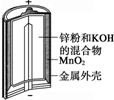 | 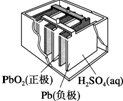 | 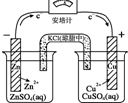 | 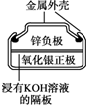 |
| Ⅰ.碱性锌锰电池 | Ⅱ.铅-硫酸蓄电池 | Ⅲ.铜锌原电池 | Ⅳ.银锌纽扣电池 |
| A. | Ⅰ所示电池工作中,MnO2的作用是催化剂 | |
| B. | Ⅱ所示电池放电过程中,硫酸浓度不断增大 | |
| C. | Ⅲ所示电池工作过程中,盐桥中K+移向硫酸锌溶液 | |
| D. | Ⅳ所示电池放电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 短周期 | ⅠA | ||||||
| ① | |||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com