
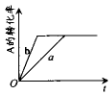
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )| A. | 增大A的浓度或减少C的浓度 | |
| B. | 缩小容器的容积或加入催化剂 | |
| C. | 升高温度或增大压强 | |
| D. | 由a变成b,A和B的物质的量与C、D的物质的量相等 |
分析 该反应为气体体积不变的反应,由图可知,使a曲线变为b曲线,反应速率加快,A的转化率不变,则改变的条件为增大压强或使用催化剂,以此来解答.
解答 解:A.增大A的浓度,A的转化率减小,减少C的浓度,反应速率减小,均与图象不符,故A不选;
B.缩小容器的容积(压强增大)或加入催化剂,均可加快反应速率,A的转化率不变,故B选;
C.反应为吸热反应,升高温度平衡正向移动,A的转化率增大,故C不选;
D.由a变成b,平衡状态不变,物质的量关系与起始物质的量、转化率有关,不能判断A和B的物质的量与C、D的物质的量是否相等,故D不选;
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度、浓度、压强对平衡影响为解答的关键,侧重分析与应用能力的考查,注意图中速率及转化率的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥⑦ | B. | 只有①③⑤⑦ | C. | 只有③④⑥ | D. | 只有①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤④① | C. | ⑤①②③④ | D. | ⑤③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY3 | D. | X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com