
【题目】下列说法正确的是( )
A. 1 mol H2O含有的质子数为10 mol
B. 0.5 mol SO42-含8 mol电子
C. 18 g水中含有的氧原子数为6.02×1022
D. 1 mol NaHSO4固体中含有的阴阳离子总数为3×6.02×1023
科目:高中化学 来源: 题型:
【题目】某品牌化妆品的主要成分Z具有美白功效,原从杨树中提取,现可用如下图所示反应合成。下列对X、Y、Z的叙述,正确的是
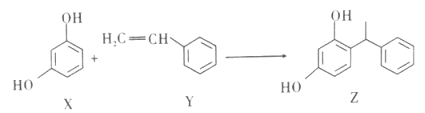
A. X、Y和Z均能和NaOH溶液反应
B. X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应
C. Y既能发生加聚反应,也能发生缩聚反应
D. Y分子中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:298K时,N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ·mol-1。
2NH3(g) △H=-92.2kJ·mol-1。
(1)若N≡N的键能为941.3kJ·mol-1,H—H的键能为436.4kJ·mol-1,则N—H的键能为___。
(2)实验室将1.1molN2、3molH2充入2L容器,一定条件下反应。保持温度和容器体积不变,
①若2min末测得H2的物质的量为1.8mol,则该时间段内氨气的平均反应速率为___。
②保持温度和容器体积不变,下列措施可加快该反应速率的是___。
A.充入He气
B.使用恰当的催化剂
C.升高反应体系的温度
D.再充入N2
③当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是___。
A.容器内N2与H2的含量
B.容器内气体密度
C.恒温下容器的压强
D.H2的物质的量
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示:
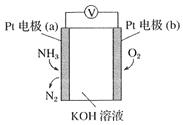
①外电路电流的运动方向:___。(填“a极到b极”或“b极到a极”)。
②b极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】读下列药品标签,有关分析不正确的是( )
选项 | A | B | C | D |
物品标签 | 饱和氯水1.01×105 Pa,20 ℃ | 药品:×××
| 碳酸氢钠NaHCO3俗名小苏打(84 g·mol-1) | 浓硫酸H2SO4 密度1.84 g·mL-1浓度98.0% |
分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该药品标签上还标有
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3 是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。下图是某科研小组以含钴废料(含少量Fe、Al 等杂质)制取[Co(NH3)6]Cl3 的工艺流程:
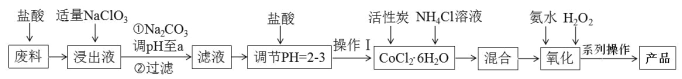
回答下列问题:
(1)写出加“适量NaClO3”发生反应的离子方程式______________。
(2)“加Na2CO3 调pH至a”会生成两种沉淀,分别为_______________________(填化学式)。
(3)操作Ⅰ的步骤包括_____________________________、冷却结晶、减压过滤。
(4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-) 过大,其原理是_________________。
(5)“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为___________(填“甲”或“乙”)同学观点正确,理由是_________________________________。写出该步骤的化学方程式:________________________________
(6)通过碘量法可测定产品中钴的含量。将 [Co(NH3)6]Cl3 转化成Co3+后,加入过量KI 溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-=2Co2++I2,I2+2S2O32-=2I-+S4O62-,实验过程中,下列操作会导致所测钴含量数值偏高的是_______。
a.用久置于空气中的 KI 固体配制溶液
b.盛装Na2S2O3标准液的碱式滴定管未润洗
c.滴定结束后,发现滴定管内有气泡
d.溶液蓝色退去,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10 s末达到平衡,此时测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
2C(g)+2D(g),反应进行到10 s末达到平衡,此时测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)10 s末,生成物D的浓度为________。
(3)A与B的平衡转化率之比为________。
(4)反应过程中容器内气体的平均相对分子质量变化是_____(填“增大”、“减小”或“不变”,下同),气体的密度变化是______。
(5)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是_______(填字母)。
A. 气体总质量保持不变 B. A、B、C、D的浓度都相等
C. 每消耗3 mol A的同时生成2 mol D D. A、B、C、D的分子数之比为3∶1∶2∶2
E. 3V正(A) = 2V逆(C) F. A的转化率保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗匹尼罗用于治疗帕金森症,治疗中度到重度的不宁腿(多动腿)综合症,罗匹尼罗(H)的一种合成路线如图所示。
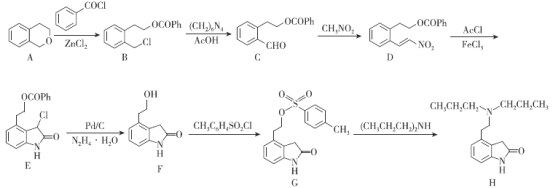
已知:①路线中Ph-代表![]() ,Ac-代表CH3COO-;
,Ac-代表CH3COO-;
②RCOOR’![]() R’OH
R’OH
请回答下列问题:
(1)D中含氧官能团的名称为___。
(2)E的分子式为___;一定条件下,1molE最多与___molH2发生加成反应(不考虑开环加成)。
(3)G→H的反应类型为___。
(4)A→B的化学方程式为___。
(5)同时满足下列条件的A的同分异构体有___种(不考虑立体异构);
①含苯环②遇FeCl3溶液显紫色③有两个取代基
其中核磁共振氢谱为5组峰且峰面积之比为4:2:2:1:1的结构简式为___。
(6)参照上述合成路线,请设计以![]() 为起始原料制备
为起始原料制备![]() 的合成路线为___(其他无机试剂任选)。
的合成路线为___(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.32g18O3中含有的质子数目为16NA
B.1LpH=2的HF溶液中所含的H+和F-的数目均为0.01NA
C.2.3gNa与一定量的氧气反应后所得固体质量为2.8g,转移电子数目为0.1NA
D.16gCH4与氯气光照完全反应生成氯代烃的分子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com