
【题目】一定温度下,反应2SO2+ O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
科目:高中化学 来源: 题型:
【题目】下列转化中,碳原子间的连接形成未发生改变的是( )
A.丙酮与HCN发生加成反应
B.1,3﹣丁二烯生成 聚1,3﹣丁二烯
C.乙二醇与重铬酸钾溶液共热被氧化为乙二酸(HOOC﹣COOH)
D.乙苯与酸性高锰酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(HF)2 (g)![]() 2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
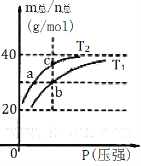
A.温度: T1<T2
B.平衡常数:K(b)<K(c)
C.反应速率:vb>va
D.当m总/n总 = 30g/mol时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( ) 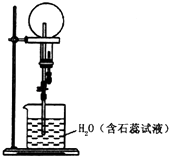
A.NH3和HCl分别形成蓝色、红色喷泉
B.制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸
C.改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同
D.去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14C是C的一种放射性核素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A. 14C核素的中子数为8 B. 14C原子最外层有6个电子
C. 14C和14N互为同位素 D. 14C16O2的质子数为46
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快是( )
A.V(H2)═0.1mol/(Lmin)
B.V(N2)═0.1mol/(Lmin)
C.V(NH3)═0.15mol/(Lmin)
D.V(N2)═0.002mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对酸雨的叙述不正确的是
A. 酸雨是指pH<5.6的雨水
B. 化石燃料的过度使用是酸雨形成的主要原因
C. 飘尘在酸雨的形成过程中起到氧化剂的作用
D. 开发新能源是控制酸雨的重要措施之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)![]() Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
反应二:Ni(CO)4(g)![]() Ni(纯,s)+4CO(g) ΔH>0
Ni(纯,s)+4CO(g) ΔH>0
下列说法错误的是( )
A. 对于反应一,适当增大压强,有利于Ni(CO)4的生成
B. 提纯过程中,CO气体可循环使用
C. 升高温度,反应一的反应速率减小,反应二的反应速率增大
D. 对于反应二,在180~200℃,温度越高,Ni(CO)4(g)的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1) 在一定条件下将CO2 和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g) +H2(g)![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g) +2H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为_____________________________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
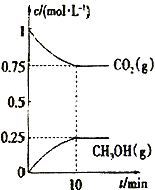
①能说明该反应已达平衡状态的是________________________。
A.单位时间内有3n molH-H键断裂,同时又有2n mol O-H键断裂
B.混合气体的密度不随时间变化
C.体系中n(CO2)/n(H2)=1∶1,且保持不变
D. CO2的体积分数在混合气体中保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是_______________。
A.升高温度 B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He使体系压强增大
③计算该温度下此反应的平衡常数K=_________(保留3位有效数字);若使K的值变为1,则应采取的措施是___________________________。
A.增大压强 B.恒压加入一定量H2 C. 升高温度 D. 降低温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积变化不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=________ mol/L
(4)被誉为改变未来世界的十大科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业。写出甲醇燃料电池碱性电解质(铂为两极。电解液为KOH 溶液)的负极电极反应:___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com