
���� ��1����������һ�����ʵ���Ũ����Һ�IJ���ѡ��ʹ�õ�������
��2������m=CVM������Ҫ���ʵ�������
��3������c=$\frac{n}{V}$�ɵã�һ�����ʵ���Ũ����Һ���Ƶ����������ʵ����ʵ���n����Һ�����V����ģ�������ʱ���ؼ�Ҫ�����ƹ���������n��V�����ı仯����n������ֵС����V������ֵ��ʱ������ʹ������ҺŨ��ƫС����n������ֵ��V������ֵСʱ������ʹ������ҺŨ��ƫ��
��� �⣺��1��ʵ����������80mL 1.4mol/L��NaNO3��Һ������ʵ������û��80mL����ƿ����Ҫѡ��100mL����ƿ��ʵ�������Ƶ���100mL 1.4mol/L��NaNO3��Һ����Ҫѡ�õ������У���Ͳ���ձ�����������100mL����ƿ����ͷ�ιܵȣ����Բ���Ҫ500mL����ƿ��
��ѡ��B��
��2��100mL 1.4mol/L��NaNO3��Һ�к��������Ƶ����ʵ���Ϊ��n��NaNO3��=1.4mol/L��0.1L=0.14mol����Ҫ�����Ƶ�����Ϊ��m��NaNO3��=85g/mol��0.14mol=11.9g��
�ʴ�Ϊ��11.9��
��3��A�����ձ����ܽ����ʣ�����ʱ��������������Һ���������ʲ�����ģ����ʵ����ʵ���ƫС����ҺŨ��ƫС���ʲ�ѡ��
B��δ��ϴ���ձ��ڱڵ���Һת��������ƿ�����²������ʲ�����ģ����ʵ����ʵ���ƫС����ҺŨ��ƫС���ʲ�ѡ��
C������ƿ���������ҺҺ��δ���̶��߱�ֹͣ��ˮ��������Һ���ƫС����ҺŨ��ƫ��ѡ��
D��������ƿ��Һ�潫�ﵽ�̶���ʱ�����ӿ̶��ߺ�Һ�棬������Һ���ƫС����ҺŨ��ƫ��ѡ��
��ѡ��CD��
���� ���⿼��������һ�����ʵ���Ũ�ȵ���Һ�ķ��������ض�ѧ�������������ͽ��ⷽ����ָ����ѵ������ȷ����ԭ�������������ǽ���ؼ���ע���������ķ����ͼ��ɣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | ��ˮŨ��/��mol•L-1�� | ����Ũ��/��mol•L-1�� | �����ҺpH |
| �� | 0.1 | 0.1 | pH=5 |
| �� | c | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
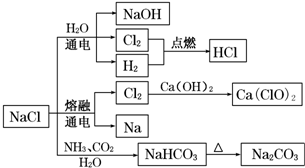
| A�� | 25�棬NaHCO3��ˮ�е��ܽ�ȱ�Na2CO3�Ĵ� | |
| B�� | NaHCO3 ���ȷֽ�ķ���ʽΪ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2�� | |
| C�� | ��ⱥ���Ȼ�����Һ�ķ���ʽΪ��2NaCl$\frac{\underline{\;���\;}}{\;}$2Na+Cl2�� | |
| D�� | ͼ����ʾת����Ӧ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ع���ʱ����������������Ӧ | |
| B�� | ��������ĵ缫��ӦΪ��O2+2H2O+4e-�T4OH- | |
| C�� | ��ظ����ĵ缫��ӦΪ��2C8H18+50 O2-�T16CO2+18H2O+100 e- | |
| D�� | �����ĵ�O2Ϊ11.2 L ����״��������������1 mol���ӷ���ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������е���ͼӦ�ų����� | |
| B�� | �þƾ�������������������Կ�������Һ���������䣬˵�������۵���������� | |
| C�� | ���Ͻ����ᣬǿ�ȴ���ʴ�����������Ŵ� | |
| D�� | �������������ڰ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
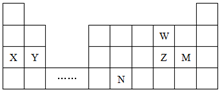
| A�� | ԭ�Ӱ뾶��Y��Z��W | |
| B�� | ���ʵĻ�ԭ�ԣ�X��Y | |
| C�� | Ԫ��Nλ�ڽ�����ǽ����ķֽ��߸����������ƶ�NԪ�صĵ��ʿ����뵼����� | |
| D�� | ����Ԫ��Mͬ���壬����������ˮ��������Ա�M��ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���AlCl3��FeCl3��CuCl2�Ļ����Һʱ��������������Cu��Fe��Al | |
| B�� | ���������ȷ�Ӧ����ȡþ | |
| C�� | ���ڸ�������ˮ������Ӧ����Fe2O3��H2 | |
| D�� | Na�����ڿ����У����ԺͿ����е��й����ʷ�����Ӧ����������Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
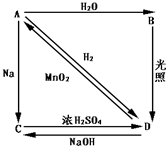 �����£�A��˫ԭ�ӷ�����̬���ʣ��Ի���ɫ��MΪ71g/mol��B��C��D���Ǻ�AԪ�صĻ����ת����ϵ��ͼ��ʾ
�����£�A��˫ԭ�ӷ�����̬���ʣ��Ի���ɫ��MΪ71g/mol��B��C��D���Ǻ�AԪ�صĻ����ת����ϵ��ͼ��ʾ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com