


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,56g乙烯和丙烯的混合气中含有的碳原子数为4NA |
| B、156g Na2O2固体与足量的二氧化碳反应时,转移的电子数为4NA |
| C、将1.06克Na2CO3固体溶于水,溶液中含CO32-数目为0.01NA |
| D、标准状况下,向溶有2.24LSO2的水溶液中,通入3.36LCl2,转移电子数目0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃、漂白粉、胆矾均为混合物 |
| B、生成盐和水的反应一定是中和反应 |
| C、NaOH、MgC12、NaC1O、NH4C1均为含共价键的离子化合物 |
| D、煤经过气化或液化两类化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H+═CO2↑+H2O |
| B、HCO3-+OHˉ═CO32-+H2O |
| C、HCO3-+H2O═H3O++CO32- |
| D、HCO3-+H2O?H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5mol?L-1 MgCl2溶液 |
| B、200mL 0.25mol?L-1 AlCl3溶液 |
| C、50mL 1mol?L-1 NaCl溶液 |
| D、25mL 0.5mol?L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
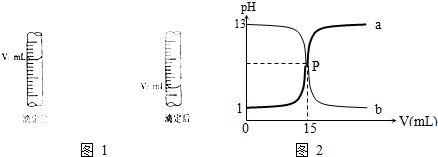
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com