
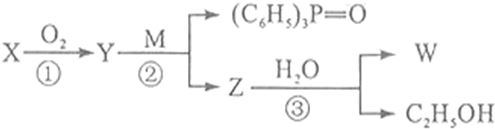
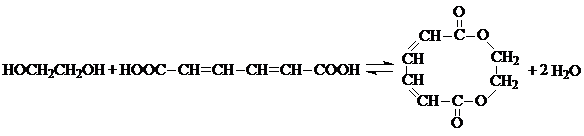 ,
,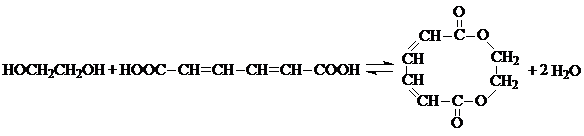 ;
;

 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
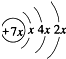 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在10-15mL之间 |
| B、恰好在15mL处 |
| C、小于15mL |
| D、大于15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com