
| A. | 分子式为C5H10O2的酯类 | B. | 分子式为C5H10的烯烃 | ||
| C. | 分子式为C5H12O的醇类 | D. | 分子式为C5H12的所有化合物 |
分析 A.分子式为C5H10O2的酯类为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,进行书写判断;
B.分子式为C5H10的烯烃,同分异构体说明含有1个C=C双键,根据碳链缩短法书写同分异构体,①先写烷烃同分异构体(烷烃碳骨架)②主链从长到短、支链由整到散、位置由心到边③“C=C”位置移动;
C.先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目;
D.烷烃只存在碳链异构,利用减链法书写同分异构体即可.
解答 解:A.若为甲酸和丁醇酯化,丁醇有4种,形成的酯有4种:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
若为乙酸和丙醇酯化,丙醇有2种,形成的酯有2种:CH3COOCH2CH2CH3、CH3COOCH(CH3)2;
若为丙酸和乙醇酯化,丙酸有1种,形成的酯有1种:CH3CH2COOCH2CH3;
若为丁酸和甲醇酯化,丁酸有2中,形成的酯有2种:CH3CH2CH2COOCH3、(CH3)2CHCOOCH3.
所以分子式为C5H10O2的酯类有9种;
B.戊烷的同分异构体有CH3-CH2-CH2-CH2-CH3、 、
、 .
.
若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;
若为 ,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;
,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;
若为 ,没有相应烯烃.
,没有相应烯烃.
所以分子式为C5H10的烯烃有5种;
C.戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,所以分子式为C5H12O的醇类有8种;
D.烷烃只存在碳链异构,利用减链法书写同分异构体,所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;
拿下1个碳原子作为支链: ;
;
拿下2个碳原子作为支链: ;
;
分子所以分子式为C5H12的所有化合物有3种;
故选A.
点评 本题考查同分异构体的书写与判断,掌握书写方法是解题的关键,难度中等,关键是形成酯的羧酸与醇的同分异构体的判断.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
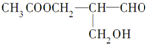 )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与氢气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
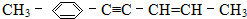 ,共面的碳原子最多有
,共面的碳原子最多有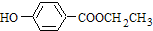 ;
;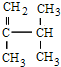 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
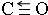 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.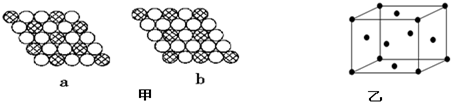
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,0.001mol•L-1的NaOH溶液pH=11 | |
| B. | 若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 | |
| C. | 25℃,0.001mol/LH2SO4溶液中,水电离出的c(OH-)为10-11mol/L | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
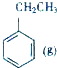 +CO2(g)?
+CO2(g)?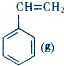 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com