
| A. | 2FeCl2+Cl2═2FeCl3,反应中氧化产物和还原产物质量比为1:1 | |
| B. | 根据反应I2+SO2+2H2O═H2SO4+2HI,说明还原性SO2<HI | |
| C. | 8NH3+3Cl2═6NH4Cl+N2中氧化剂和还原剂物质的量之比为3:8 | |
| D. | KClO3+6HCl═3Cl2+KCl+3H2O,每生成3molCl2,转移电子6mol |
分析 A.根据化合价降低生成还原产物,化合价升高生成氧化产物判断;
B.根据还原剂的还原性大于还原产物的还原性判断;
C.根据化合价降低的反应物为氧化剂,化合价升高生成氧化的反应物为还原剂判断;
D.反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价.
解答 解:A.2FeCl2+Cl2═2FeCl3反应中Cl2化合价降低生成2Cl-为还原产物,2FeCl2化合价升高生成2Fe3+为氧化产物,所以氧化产物和还原产物质量比为1:1,故A正确;
B.根据还原剂的还原性大于还原产物的还原性,所以I2+SO2+2H2O═H2SO4+2HI,说明还原性SO2>HI,故B错误;
C.反应中Cl2为氧化剂,NH3为还原剂,由方程式可知,当有8molNH3参加反应,有2mol被氧化,则该反应中氧化剂与还原剂的物质的量之比为3:2,故C错误;
D.该反应中,氯酸钾中氯元素的化合价由+5价变为0价,HCl中Cl元素化合价由-1价升高到0价,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握电子守恒及反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学准确称取5.0gNaCl配制一定物质的量浓度的溶液时,乙同学发现NaCl固体与砝码放反了,但乙同学认为这个错误操作对实验结果没有影响 | |
| B. | 做酯化反应反应混合液的配制应先加乙醇,再加浓硫酸,冷却后最后加入乙酸 | |
| C. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| D. | 要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18g重水(D2O)所含的电子数为10NA | |
| B. | 常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 将铜丝插入足量浓硝酸中:Cu+8H++2NO3-═3Cu2++2NO2↑+H2O | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


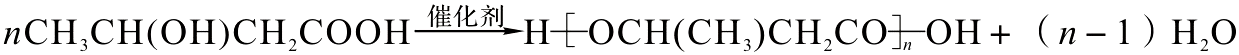 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com