
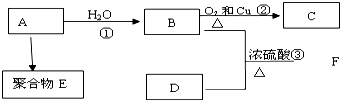
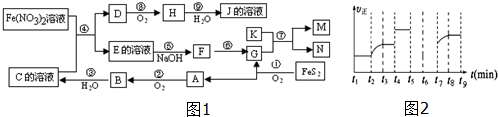
·ÖĪö Ō×ÓŠņŹżÓÉŠ”µ½“óÅÅĮŠµÄĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢W£¬ĖÄÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ32£¬ŌŚÖÜĘŚ±ķÖŠXŹĒŌ×Ó°ė¾¶×īŠ”µÄŌŖĖŲ£¬ŌņXĪŖHŌŖĖŲ£»Y”¢Z×óÓŅĻąĮŚ£¬Z”¢WĪ»ÓŚĶ¬Ö÷×壬¹ŹY”¢Z”¢WŌ×ÓŠņŹżÖ®ŗĶĪŖ31£¬ÉčZµÄŌ×ÓŠņŹżĪŖa£¬ŌņYµÄŌ×ÓŠņŹżĪŖa-1£¬WµÄŌ×ÓŠņŹżĪŖa+8£¬¹Źa-1+a+a+8=31£¬a=8£¬¹ŹZĪŖO”¢YĪŖN”¢WĪŖS£¬
£Ø1£©øł¾Ż·ÖĪöæÉÖŖXĪŖĒāŌŖĖŲ£»
£Ø2£©³£¼ūŌŖĖŲĒā”¢Ńõ”¢µŖ”¢ĮņŠĪ³ÉµÄ»ÆŗĻĪļ£¬ŹōÓŚĒæĖįĒŅÓėĶ·“Ó¦µÄĪŖĻõĖį£¬ĶÓėĻ”ĻõĖį·“Ӧɜ³ÉĻõĖįĶ”¢Ņ»Ńõ»ÆµŖŗĶĖ®£»
£Ø3£©Ēā”¢Ńõ”¢µŖ”¢ĮņŠĪ³ÉµÄ»ÆŗĻĪļ£¬øł¾ŻĢāÄæŅŖĒó£¬ÅŠ¶Ļļ§øłĄė×ӵďżĮæŗĶĮņĖįøł”¢ŃĒĮņĖįøłĄė×ÓµÄĮ棬²¢Š“ĻąÓ¦µÄ·½³ĢŹ½£»
£Ø4£©Ēā”¢µŖ”¢Ńõ”¢Įņ”¢ĢśŠĪ³ÉµÄ»ÆŗĻĪļ£¬øł¾ŻÓŠĘųĢå·Å³ö£¬ÓŠ°×É«³ĮµķÉś³É£¬ŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īŗó±ä³ÉŗģŗÖÉ«£¬æÉŅŌČ·¶ØÓŠļ§øłĄė×ÓŗĶŃĒĢśĄė×Ó£¬øł¾ŻÓėĀČ»Æ±µ·“Ӧɜ³É³Įµķ£¬ĒŅ³Įµķ²»ČÜÓŚĻõĖį£¬æÉŅŌÅŠ¶Ļŗ¬ÓŠĮņĖįøłĄė×Ó£¬øł¾Żŗ¬½į¾§Ė®µÄĮæŗĶĻą¶Ō·Ö×ÓÖŹĮææÉŅŌµĆ³ö»ÆѧŹ½£®
½ā“š ½ā£ŗŌ×ÓŠņŹżÓÉŠ”µ½“óÅÅĮŠµÄĖÄÖÖ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢W£¬ĖÄÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ32£¬ŌŚÖÜĘŚ±ķÖŠXŹĒŌ×Ó°ė¾¶×īŠ”µÄŌŖĖŲ£¬ŌņXĪŖHŌŖĖŲ£»Y”¢Z×óÓŅĻąĮŚ£¬Z”¢WĪ»ÓŚĶ¬Ö÷×壬¹ŹY”¢Z”¢WŌ×ÓŠņŹżÖ®ŗĶĪŖ31£¬ÉčZµÄŌ×ÓŠņŹżĪŖa£¬ŌņYµÄŌ×ÓŠņŹżĪŖa-1£¬WµÄŌ×ÓŠņŹżĪŖa+8£¬¹Źa-1+a+a+8=31£¬a=8£¬¹ŹZĪŖO”¢YĪŖN”¢WĪŖS£¬
£Ø1£©øł¾Ż·ÖĪöæÉÖŖ£¬XĪŖHŌŖĖŲ£¬
¹Ź“š°øĪŖ£ŗH£»
£Ø2£©ÓÉĒā”¢µŖ”¢Ńõ”¢ĮņÖŠµÄČżÖÖ×é³ÉµÄÄÜÓėĶ·“Ó¦µÄĒæĖįĪŖĻõĖį£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ3Cu+2NO3-+8H+ØT3Cu2++2NO”ü+4H2O£¬
¹Ź“š°øĪŖ£ŗ3Cu+2NO3-+8H+ØT3Cu2++2NO”ü+4H2O£»
£Ø3£©¢ŁÓÉĒā”¢µŖ”¢Ńõ”¢Įņ×é³ÉµÄĄė×Ó»ÆŗĻĪļæÉÄÜĪŖĮņĖįļ§”¢ĮņĖįĒāļ§”¢ŃĒĮņĖįļ§”¢ŃĒĮņĖįĒāļ§µČ£¬1 molÉś³ÉĘųĢå2 molĖµĆ÷Ņ»·Ö×ÓÕāÖÖĄė×Ó»ÆŗĻĪļÖŠŗ¬ÓŠ2·Ö×Óļ§øłĄė×Ó£¬ļ§øłĄė×ÓÓėĒāŃõøłĄė×Ó·“Ó¦·½³ĢŹ½ĪŖNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$H2O+NH3”ü£¬
¹Ź“š°øĪŖ£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$H2O+NH3”ü£»
¢Ś“ĖÖÖ»ÆŗĻĪļÓėĀČĘų·“Ó¦ĖµĆ÷ĪŖŃĒĮņĖįøłĄė×Ó£¬¹Ź“ĖÖÖ»ÆŗĻĪļĪŖŃĒĮņĖįļ§£¬ÓėĀČĘų·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ¢ŚSO32-+Cl2+H2O=SO42-+2Cl-+2H+£¬
¹Ź“š°øĪŖ£ŗSO32-+Cl2+H2O=SO42-+2Cl-+2H+£»
£Ø4£©¢ŁBÖŠŗ¬ÓŠĒā”¢µŖ”¢Ńõ”¢Įņ”¢ĢśĪåÖÖŌŖĖŲ£¬Č”BµÄČÜŅŗ¼ÓČė¹żĮæÅØNaOHČÜŅŗ²¢¼ÓČČ£¬²śÉś°×É«³ĮµķŗĶĪŽÉ«“Ģ¼¤ŠŌĘųĪ¶ĘųĢ壮¹żŅ»¶ĪŹ±¼ä°×É«³Įµķ±äĪŖ»ŅĀĢÉ«£¬×īÖÕ±äĪŖŗģŗÖÉ«£¬ĖµĆ÷BÖŠÓŠŃĒĢśĄė×ÓŗĶļ§øłĄė×Ó£¬BµÄČÜŅŗ£¬¼ÓČė¹żĮæBaCl2ČÜŅŗ²śÉś°×É«³Įµķ£¬¼ÓŃĪĖį³Įµķ²»Čܽā£¬ĖµĆ÷ÓŠĮņĖįøłĄė×Ó£¬1mol BÖŠŗ¬ÓŠ6mol½į¾§Ė®£¬ĖµĆ÷B“ųĮłøö½į¾§Ė®£¬ÓÉĻą¶Ō·Ö×ÓÖŹĮæĪŖ392æÉÖŖµĄ·Ö×ÓŹ½Ö»ÄÜĪŖ£ØNH4£©2Fe £ØSO4£©2•6H2O£¬
¹Ź“š°øĪŖ£ŗ£ØNH4£©2Fe £ØSO4£©2•6H2O£»
¢ŚBµÄĪļÖŹµÄĮæĪŖ0.1 mol£¬øßĆĢĖįøłĄė×ÓµÄĪļÖŹµÄĮæĪŖ0.02 mol£¬ĖµĆ÷ŃĒĢśĄė×ÓÓėøßĆĢĖįøłĄė×ÓŅŌ5£ŗ1µÄ±ČĄżĒ”ŗĆĶźČ«·“Ó¦£¬¹ŹĄė×Ó·½³ĢŹ½ĪŖ¢Ś5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O£¬
¹Ź“š°øĪŖ£ŗ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪ»ÖĆ”¢½į¹¹ÓėŠŌÖŹ¹ŲĻµµÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£¬ÕżČ·ĶʶĻø÷ŌŖĖŲĪŖ½ā“š¹Ų¼ü£¬×¢ŅāŹģĮ·ÕĘĪÕŌ×Ó½į¹¹ÓėŌŖĖŲÖÜĘŚ±ķ”¢ŌŖĖŲÖÜĘŚĀɵĹŲĻµ£¬ŹŌĢāÖŖŹ¶µć½Ļ¶ą”¢×ŪŗĻŠŌ½ĻĒ棬³ä·Öæ¼²éĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°Įé»īÓ¦ÓĆÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
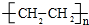 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
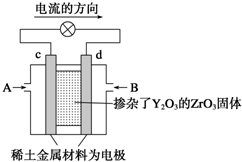 æĘѧ¼ŅÖĘŌģ³öŅ»ÖÖŹ¹ÓĆ¹ĢĢåµē½āÖŹµÄČ¼ĮĻµē³Ų£¬Ę䊧ĀŹøüøߣ¬æÉÓĆÓŚŗ½Ģģŗ½æÕ£®ČēĻĀĶ¼ĖłŹ¾×°ÖĆÖŠ£¬ŅŌĻ”ĶĮ½šŹō²ÄĮĻ×÷¶čŠŌµē¼«£¬ŌŚĮ½¼«ÉĻ·Ö±šĶØČė±ūĶéŗĶæÕĘų£¬ĘäÖŠ¹ĢĢåµē½āÖŹŹĒ²ōŌÓĮĖY2O3µÄZrO3¹ĢĢ壬ĖüŌŚøßĪĀĻĀÄÜ“«µ¼Õż¼«Éś³ÉµÄO2-£®
æĘѧ¼ŅÖĘŌģ³öŅ»ÖÖŹ¹ÓĆ¹ĢĢåµē½āÖŹµÄČ¼ĮĻµē³Ų£¬Ę䊧ĀŹøüøߣ¬æÉÓĆÓŚŗ½Ģģŗ½æÕ£®ČēĻĀĶ¼ĖłŹ¾×°ÖĆÖŠ£¬ŅŌĻ”ĶĮ½šŹō²ÄĮĻ×÷¶čŠŌµē¼«£¬ŌŚĮ½¼«ÉĻ·Ö±šĶØČė±ūĶéŗĶæÕĘų£¬ĘäÖŠ¹ĢĢåµē½āÖŹŹĒ²ōŌÓĮĖY2O3µÄZrO3¹ĢĢ壬ĖüŌŚøßĪĀĻĀÄÜ“«µ¼Õż¼«Éś³ÉµÄO2-£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
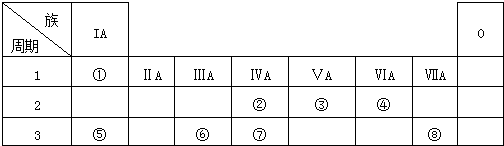
| A£® | ĪļÖŹµÄČŪµć£ŗŹÆÓ¢£¾Ź³ŃĪ£¾±ł£¾¹Æ | |
| B£® | ČČĪČ¶ØŠŌ£ŗPH3£¾H2S£¾HBr£¾NH3 | |
| C£® | Ī¢Į£°ė¾¶Óɓ󵽊”Ė³ŠņŹĒ£ŗH-£¾Li+£¾H+ | |
| D£® | ·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹĮ£×ÓµÄÖ±¾¶£ŗFe£ØOH£©3Šü×ĒŅŗ£¾Fe£ØOH£©3½ŗĢ壾FeCl3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
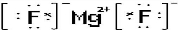 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
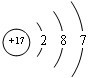 £®
£®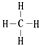 £¬¢ŚŗĶ¢ßµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌĻą±Č£¬ĘäÖŠ½ĻČõµÄŹĒSiH4 £ØÓĆøĆĒā»ÆĪļµÄ»ÆѧŹ½±ķŹ¾£©£®
£¬¢ŚŗĶ¢ßµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌĻą±Č£¬ĘäÖŠ½ĻČõµÄŹĒSiH4 £ØÓĆøĆĒā»ÆĪļµÄ»ÆѧŹ½±ķŹ¾£©£®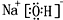 £¬ŠĪ³ÉµÄ¾§ĢåŹĒĄė×Ó¾§Ģ壮
£¬ŠĪ³ÉµÄ¾§ĢåŹĒĄė×Ó¾§Ģ壮²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com