
| A、平衡时,B的转化率为80% | ||
B、平衡时,容器内压强为原来的
| ||
| C、平衡时,C的浓度为0.5mol/L | ||
| D、A的平均反应速率为0.30mol/(L?min) |
 C(g)+2D(g)
C(g)+2D(g) C(g)+2D(g)
C(g)+2D(g)| 0.5 |
| 2.5 |
| 1.5mol+2mol+0.5mol+1mol |
| 3mol+2.5mol |
| 10 |
| 11 |
| 0.5mol |
| 2L |
| ||
| 5min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
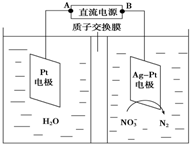 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A、Pt电极为阴极 |
| B、电解过程中H+向正极移动 |
| C、理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5 |
| D、电解过程中Pt电极附近溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物和氧化物的性质进行了更深入的研究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物和氧化物的性质进行了更深入的研究.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com