
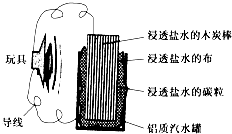
 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
分析 该装置构成原电池,铝易失电子作负极、碳作正极,负极上电极反应式为Al-3e-=Al3+,正极上电极反应式为O2+2H2O+4e-=4OH-,原电池放电时,正极应与玩具电机的正极相连.
解答 解:A.该电池放电时,部分化学能转化为热能,所以电能的能量转化率不是100%,故A正确;
B.铝易失电子发生氧化反应而作负极,电极反应式为Al-3e-=Al3+,故B正确;
C.放电时,碳棒应该与玩具电机的正极相连,故C正确;
D.正极电极反应式为O2+2H2O+4e-=4OH-,所以碳棒和炭粒质量不变,故D错误;
故选D.
点评 本题考查了原电池原理,明确正负极的判断方法、正负极上发生的反应是解本题关键,实际上该装置是铝的吸氧腐蚀,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
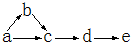 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
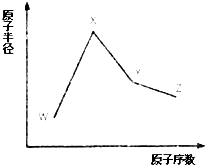 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子的球棍模型: | |
| B. | H2O2的电子式: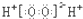 | |
| C. | 乙醇的分子式:C2H5OH | |
| D. | 离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
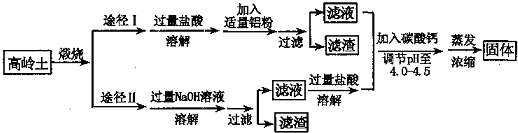
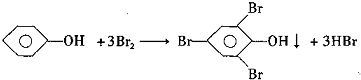
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的碳原子不在同一条直线上 | B. | 光照下能够发生取代反应 | ||
| C. | 比丁烷更容易液化 | D. | 是石油分馏的一种产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com