
| A£® | ÉĻŹöŌŖĖŲÖŠ£¬YµÄŌ×Ó°ė¾¶×ī“ó | |
| B£® | ÉĻŹöŌŖĖŲÖŠ£¬WµÄĘųĢ¬Ēā»ÆĪļ×īĪČ¶Ø | |
| C£® | ŌŖĖŲWŗĶXæÉŠĪ³Éŗ¬ÓŠ¼«ŠŌ¼üµÄ¼«ŠŌ·Ö×ÓWX3 | |
| D£® | ¹¤ŅµÉĻæÉÓƵē½āČŪČŚµÄY”¢ZµÄ»ÆŗĻĪļµÄ·½·ØŅ±Į¶Y”¢ZµÄµ„ÖŹ |
·ÖĪö W”¢X”¢Y”¢Z¾łŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬Y+ŗĶZ-Ąė×Ó¾ßÓŠÓėÄŹŌ×ÓĻąĶ¬µÄµē×Ó²ć½į¹¹£¬ŌņYŹĒNaŌŖĖŲ”¢ZĪŖFŌŖĖŲ£»WŌŖĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹżÓė“ĪĶā²ćµē×ÓŹżÖ®²īµÄ¾ų¶ŌÖµµČÓŚĘäµē×Ó²ćŹż£¬WĪŖC»ņPŌŖĖŲ£»
XŌŖĖŲµÄŌ×Ó±ČWŌŖĖŲµÄŌ×Ó¶ą2øöµē×Ó£¬ŌņXĪŖO»ņClŌŖĖŲ£»
A£®Ō×Óµē×Ó²ćŹżŌ½¶ąĘäŌ×Ó°ė¾¶ŌŖĖŲ£¬Ķ¬Ņ»ÖÜĘŚŌŖĖŲ£¬Ō×Ó°ė¾¶Ėę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õŠ”£»
B£®ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ĘäĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌŌ½Ē棻
C£®²»Ķ¬·Ē½šŹōŌŖĖŲÖ®¼äŅ׊Ī³É¼«ŠŌ¼ü£¬ÕżøŗµēŗÉÖŠŠÄ²»ÖŲŗĻµÄ·Ö×ÓĪŖ¼«ŠŌ·Ö×Ó£»
D£®»īĘĆ½šŹō²ÉÓƵē½āĘäČŪČŚŃĪ»ņŃõ»ÆĪļµÄ·½·ØŅ±Į¶£®
½ā“š ½ā£ŗW”¢X”¢Y”¢Z¾łŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬Y+ŗĶZ-Ąė×Ó¾ßÓŠÓėÄŹŌ×ÓĻąĶ¬µÄµē×Ó²ć½į¹¹£¬ŌņYŹĒNaŌŖĖŲ”¢ZĪŖFŌŖĖŲ£»WŌŖĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹżÓė“ĪĶā²ćµē×ÓŹżÖ®²īµÄ¾ų¶ŌÖµµČÓŚĘäµē×Ó²ćŹż£¬WĪŖC»ņPŌŖĖŲ£»
XŌŖĖŲµÄŌ×Ó±ČWŌŖĖŲµÄŌ×Ó¶ą2øöµē×Ó£¬ŌņXĪŖO»ņClŌŖĖŲ£»
A£®Ō×Óµē×Ó²ćŹżŌ½¶ąĘäŌ×Ó°ė¾¶ŌŖĖŲ£¬Ķ¬Ņ»ÖÜĘŚŌŖĖŲ£¬Ō×Ó°ė¾¶Ėę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õŠ”£¬Õā¼øÖÖŌŖĖŲÖŠŌ×Ó°ė¾¶×ī“óµÄŹĒNaŌŖĖŲ£¬¼“YŌŖĖŲ£¬¹ŹAÕżČ·£»
B£®ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ĘäĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌŌ½Ē棬Õā¼øÖÖŌŖĖŲÖŠ·Ē½šŹōŠŌ×īĒæµÄŹĒFŌŖĖŲ£¬ĖłŅŌZµÄĒā»ÆĪļĪČ¶ØŠŌ×īĒ棬¹ŹB“ķĪó£»
C£®²»Ķ¬·Ē½šŹōŌŖĖŲÖ®¼äŅ׊Ī³É¼«ŠŌ¼ü£¬ÕżøŗµēŗÉÖŠŠÄ²»ÖŲŗĻµÄ·Ö×ÓĪŖ¼«ŠŌ·Ö×Ó£¬WŹĒC»ņPŌŖĖŲ”¢XĪŖO»ņClŌŖĖŲ£¬ŌŖĖŲWŗĶXæÉŠĪ³Éŗ¬ÓŠ¼«ŠŌ¼üµÄ¼«ŠŌ·Ö×ÓPCl3£¬¹ŹCÕżČ·£»
D£®»īĘĆ½šŹō²ÉÓƵē½āĘäČŪČŚŃĪ»ņŃõ»ÆĪļµÄ·½·ØŅ±Į¶£¬YŹĒ»īĘĆ½šŹōŌŖĖŲNa”¢ZŹĒ»īĘĆ·Ē½šŹōŌŖĖŲF£¬æÉŅŌ²ÉÓƵē½āČŪČŚNaFµÄ·½·ØµĆµ½ÄĘŗĶ·śĘų£¬¹ŹDÕżČ·£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éŌ×Ó½į¹¹ŗĶŌŖĖŲŠŌÖŹ£¬ĪŖøßæ¼øßʵµć£¬Éę¼°½šŹōŅ±Į¶”¢ŌŖĖŲÖÜĘŚĀÉ”¢·Ö×Ó¼«ŠŌŗĶ»Æѧ¼ü¼«ŠŌÅŠ¶Ļ£¬ÕżČ·ĶʶĻŌŖĖŲŹĒ½ā±¾Ģā¹Ų¼ü£¬ÖŖµĄ³£¼ū½šŹōŅ±Į¶·½·ØÓė½šŹō»īĘĆŠŌĒæČõ¹ŲĻµ£¬ĢāÄæÄŃ¶Č²»“ó£®


 Ó¦ÓĆĢā×÷Ņµ±¾ĻµĮŠ“š°ø
Ó¦ÓĆĢā×÷Ņµ±¾ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Q1=Q2 | B£® | Q1£¾Q2 | C£® | Q1£¼Q2 | D£® | ĪŽ·ØÅŠ¶Ļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
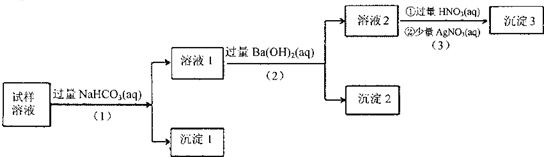
| A£® | ³Įµķ2·ÅÖĆŌŚæÕĘųÖŠ£¬ČōÖŹĮæŌö¼Ó£¬ŹŌŃłÖŠæĻ¶Ø“ęŌŚSO32- | |
| B£® | ŹŌŃłČÜŅŗÖŠ¼ÓČĖÉŌ¹żĮæµÄNH4C1ČÜŅŗÄܵƵ½Óė³Įµķ1³É·ÖĻąĶ¬µÄĪļÖŹ | |
| C£® | ÉĻŹöĮ÷³Ģ²½Öč£Ø1£©£Ø2£©£Ø3£©µÄĖ³ŠņøÄĪŖ£Ø3£©£Ø2£©£Ø1£©£¬æÉÄÜ»į»ńµĆĻąĶ¬µÄŹµŃéĻÖĻó | |
| D£® | ŹŌŃłČÜŅŗÖŠæĻ¶Ø“ęŌŚA102-”¢Cl-£¬ĘäÖŠNa+”¢K+ÖĮÉŁ“ęŌŚ1ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ČõĖį | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54”Į10-2 | 2.95”Į10-8 | 4.30”Į10-7 |
| Ka2 | 1.02”Į10-7 | - | 5.61”Į10-11 |
| A£® | NaClOČÜŅŗÖŠĶØČėÉŁĮæCO2£ŗClO-+H2O+CO2ØTHCO3-+HClO | |
| B£® | ĀČĖ®ÖŠ¼ÓČėÉŁĮæNaCO3·ŪÄ©£ŗHCO3-+H+ØTH2O+CO2”ü | |
| C£® | NaClOČÜŅŗÖŠĶØČėÉŁĮæSO2£ŗ2ClO-+H2O+SO2ØTSO32-+2HClO | |
| D£® | Na2CO2ČÜŅŗÖŠ»ŗĀżĶØČėÉŁĮæSO2£ŗ2CO32-+H2O+SO2ØTSO32-+2HCO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
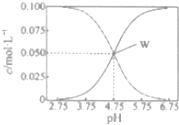 25”ꏱ£¬ÓŠc£ØCH2COOH£©+c£ØCH2COO-£©=0.1mol•L-1µÄŅ»×é“×Ėį”¢“×ĖįÄĘ»ģŗĻČÜŅŗ£¬ČÜŅŗÖŠc£ØCH2COOH£©”¢c£ØCH2COO-£©ÓėpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµµÄŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
25”ꏱ£¬ÓŠc£ØCH2COOH£©+c£ØCH2COO-£©=0.1mol•L-1µÄŅ»×é“×Ėį”¢“×ĖįÄĘ»ģŗĻČÜŅŗ£¬ČÜŅŗÖŠc£ØCH2COOH£©”¢c£ØCH2COO-£©ÓėpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµµÄŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | 25”ꏱ£¬“×ĖįµÄµēĄė³£ŹżKa=1”Į10-4.75 | |
| B£® | WµćĖł±ķŹ¾µÄČÜŅŗÖŠ£ŗc£ØNa+£©+c£ØH+£©=c£ØCH3COOH£©+c£ØOH-£© | |
| C£® | pH=5.5µÄČÜŅŗÖŠ£ŗc£ØCH3COOH£©£¾c£ØCH3COO-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| D£® | pH=3.5µÄČÜŅŗÖŠ£ŗc£ØNa+£©+c£ØH+£©-c£ØOH-£©+c£ØCH3COOH£©=0.1mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹č½ŗ×÷øÉŌļ¼ĮŹĒĄūÓĆĘ䶹æ×”¢Īüø½Ė®·ÖµÄÄÜĮ¦Ēæ | |
| B£® | ĀĮŌŚæÕĘųÖŠ±ŲŠė³öĮ¼ŗƵÄæ¹øÆŹ“ŠŌ£¬ĖµĆ÷ĀĮ¼«ÄŃÓėŃõĘų·“Ó¦ | |
| C£® | Ć÷·ÆæÉÓĆÓŚŅūĖ®µÄĻū¶¾É±¾ś | |
| D£® | ¹āµ¼ĻĖĪ¬±ČĘÕĶصēĄĀÓŠøüĒæµÄ“«ŹäŠÅĻ¢ÄÜĮ¦£¬ŹĒŅņĪŖĘäµ¼µēÄÜĮ¦Ēæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆČÜŅŗÖŠ£¬Na+”¢Fe3+”¢NO3-”¢Cl-æÉÄÜ“óĮæ¹²“ę | |
| B£® | ŗĶäåĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗBr2+SO32-+H2O=2H++2Br-+SO42- | |
| C£® | ŗĶBa£ØOH£©2ČÜŅŗ¼ÓČČ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O | |
| D£® | 1L0.1mol•L-1øĆČÜŅŗŗĶ×ćĮæµÄĻõĖį³ä·Ö·“Ó¦£¬Éś³É2.24L£Ø±ź×¼×“æö£©SO2ĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 µŚ¢ö×åµÄŃõ”¢Įņ”¢Īų£ØSe£©”¢ķŚ£ØTe£©µČŌŖĖŲŌŚ»ÆŗĻĪļÖŠ³£±ķĻÖ³ö¶ąÖÖ¼ŪĢ¬£¬ŗ¬µŚ¢ö×åŌŖĖŲµÄ»ÆŗĻĪļŌŚŃŠ¾æŗĶÉś²śÖŠÓŠŠķ¶ąÖŲŅŖÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£®
µŚ¢ö×åµÄŃõ”¢Įņ”¢Īų£ØSe£©”¢ķŚ£ØTe£©µČŌŖĖŲŌŚ»ÆŗĻĪļÖŠ³£±ķĻÖ³ö¶ąÖÖ¼ŪĢ¬£¬ŗ¬µŚ¢ö×åŌŖĖŲµÄ»ÆŗĻĪļŌŚŃŠ¾æŗĶÉś²śÖŠÓŠŠķ¶ąÖŲŅŖÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £Øg£©$\stackrel{“߻ƼĮ}{?}$
£Øg£©$\stackrel{“߻ƼĮ}{?}$ £Øg£©+3H2£Øg£©”÷H
£Øg£©+3H2£Øg£©”÷H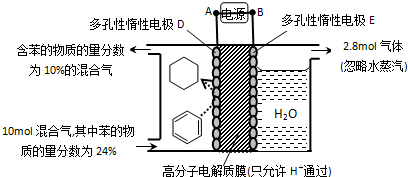
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com