
【题目】W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为![]() 的具有漂白性的物质,工业上常用电解饱和
的具有漂白性的物质,工业上常用电解饱和![]() 溶液来获得Z的单质及其他产品。下列说法正确的是( )
溶液来获得Z的单质及其他产品。下列说法正确的是( )
A.W和X 、Y 、Z均能形成18电子的分子
B.X 、Y 之间形成的化合物可能同时含有离子键和非极性共价健
C.上述四种元素的原子半径大小顺序为![]()
D.W、X 、Z三种元素形成的化合物一定是弱酸
【答案】B
【解析】
W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,则W为H元素;工业上常用电解饱和食盐水获得氢氧化钠、氯气和氢气,则YZ为NaCl,X、Y可形成原子个数比为1:1的具有漂白性的物质为Na2O2,X为Na,Y为O,即:W、X、Y、Z分别为:H、O、Na、Cl,结合原子结构特点及元素性质解答。
依据上述分析可知:W、X、Y、Z分别为:H、O、Na、Cl;
A. 氢与钠形成化合物为NaH,含有电子数为12,故A错误;
B. X 、Y 之间形成的化合物可以为Na2O2,同时含有离子键和非极性共价健,故B正确;
C. 电子层不同的电子层越多,原子半径越大,电子层相同的,原子序数越大,原子半径越小,所以上述四种元素的原子半径大小顺序为:r(Na)>r(Cl)>r(O)>r(H),即:r(Y)>r(Z)>r(X)>r(W),故C错误;
D. W、X、Z三种元素形成的化合物可以为HClO4,高氯酸为强酸,故D错误;
故选B。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8组物质或粒子:
①14N和14C
②16O和18O
③氰酸铵(NH4CNO)与尿素[CO(NH2)2]
④足球烯(C60)和金刚石
⑤CH3CH2CH2CH3和CH(CH3)3
⑥CH3CH2CH3和CH3(CH2)2CH3
⑦![]() 和
和![]()
⑧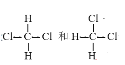
(1)互为同素异形体的是____________(填编号,下同),
(2)互为同位素的是____________,
(3)互为同系物的是____________,
(4)互为同分异构体的是____________。
Ⅱ.回答下列有关有机化学的问题:
(5)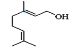 的分子式为____________,该物质所含官能团名称是____________。
的分子式为____________,该物质所含官能团名称是____________。
(6)苯与浓硫酸和浓硝酸混合加热产生硝基苯的反应方程式为____________,反应类型是____________。
(7)下列能使酸性高锰酸钾溶液褪色的是____________。
A.乙醇 B.聚乙烯 C.苯 D.甲苯 E.戊烷 F.苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加水②加![]() 固体③滴入几滴浓盐酸④加
固体③滴入几滴浓盐酸④加![]() 固体⑤加
固体⑤加![]() 溶液⑥滴入几滴硫酸铜溶液⑦适当升高温度(不考虑盐酸挥发)
溶液⑥滴入几滴硫酸铜溶液⑦适当升高温度(不考虑盐酸挥发)
A.①⑥⑦B.③⑦C.③⑤D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液A中可能含有如下离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学设计并完成了如下的实验:
。某同学设计并完成了如下的实验:
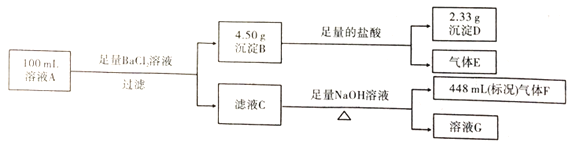
下列说法正确的是
A.气体F能使湿润的蓝色石蕊试纸变红
B.溶液A中一定存在![]() 、
、![]() 、
、![]() ,可 能存在
,可 能存在![]()
C.溶液A中一定存在![]() 、
、![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]()
D.溶液A中可能存在![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 92.0 g甘油(丙三醇)中含有羟基数为1.0NA
C. 22.4 L(标准状况)氩气含有的质子数为18NA
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置Ⅰ是实验室常见的装置,用途广泛(用序号或字母填空)。
(1)用它作为气体收集装置:若从a端进气可收集的有___,若从b端进气可收集的气体有___。
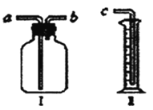
①O2 ②CH4 ③CO2 ④CO ⑤H2 ⑥N2 ⑦NH3
(2)用它作为洗气装置。若要除去CO2气体中混有的少量水蒸气,则广口瓶中盛放___,气体应从____端通入。
(3)将它与装置Ⅱ连接作为量气装置。将广口瓶中装满水,用乳胶管连接好装置,从___端通入气体。
(4)某实验需要用1.0molL-1NaOH溶液500mL。配制实验操作步骤有:
a.在天平上称量NaOH固体,加水溶解,冷却至室温。
b.把制得的溶液小心地注入一定容积容量瓶中。
c.继续向容量瓶中加水至距刻度线1cm~2cm处,改用胶头滴管加水至刻度线。
d.用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀。
e.将容量瓶塞塞紧,充分摇匀。
填写下列空白:
①配制该溶液应当称取___克NaOH固体。
②操作步骤和正确顺序为____。
③如图该配制过程中两次用到玻璃棒,其作用分别是____、___。
④定容时,若俯视刻度线,会使结果____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下制得氯气的各个反应中,氯元素既被氧化又被还原的是
A.2KClO3+I2=2KIO3+Cl↓
B.Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
C.4HCl+O2 ![]() 2Cl2+2H2O
2Cl2+2H2O
D.2NaCl+2H2O ![]() 2NaOH+H2↓+Cl2↑
2NaOH+H2↓+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备![]() 和
和![]() 的流程如图所示:
的流程如图所示:
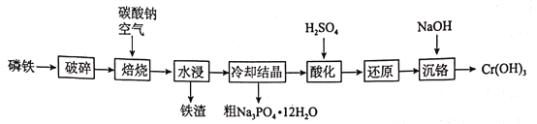
已知:水浸后溶液的主要成分为![]() 和
和![]() ;
;![]() 的
的![]() 回答下列问题:
回答下列问题:
(1)“破碎”的目的为________________________________________________________。
(2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。
(3)进一步提纯粗磷酸钠晶体的方法为________________。
(4)“酸化”时发生反应的离子方程式为________________________________________________。
(5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知:![]() ,离子浓度为10-5mol/L时可认为该离子沉淀完全)
,离子浓度为10-5mol/L时可认为该离子沉淀完全)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com