
| 选项 | 实验操作 | 实验目的或结论 |
| A | 往某溶液中加入BaCl2溶液产生白色沉淀 | 该溶液含有SO42- |
| B | 将氯气分别通入KI溶液和NaBr溶液中 | 证明还原性的强弱:I->Br->Cl- |
| C | 由Fe-Cu做电极,浓硝酸做电解质溶液组成的原电池 | 证明金属活泼性Fe>Cu |
| D | C2H5OH与浓硫酸170℃共热,制得的气体先通过足量的NaOH溶液,再通入酸性KMnO4溶液 | 使KMnO4溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl;
B.氯气分别通入KI溶液和NaBr溶液,分别生成碘、溴;
C.浓硝酸做电解质时Fe为正极,Cu为负极;
D.C2H5OH与浓硫酸170℃共热,发生消去反应生成乙烯,先通过足量的NaOH溶液除去杂质,再通入酸性KMnO4溶液可检验乙烯.
解答 解:A.白色沉淀可能为AgCl,则原溶液可能含银离子或硫酸根离子,但二者不能同时存在,故A错误;
B.氯气分别通入KI溶液和NaBr溶液,分别生成碘、溴,由还原剂的还原性大于还原产物的还原性可知,还原性为I->Cl-,Br->Cl-,不能比较I-、Br-的还原性,故B错误;
C.浓硝酸做电解质时Fe为正极,Cu为负极,Cu失去电子,而金属活泼性为Fe>Cu,二者不一致,故C错误;
D.C2H5OH与浓硫酸170℃共热,发生消去反应生成乙烯,先通过足量的NaOH溶液除去杂质,再通入酸性KMnO4溶液,观察褪色可检验乙烯,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、氧化还原反应、原电池、有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:实验题
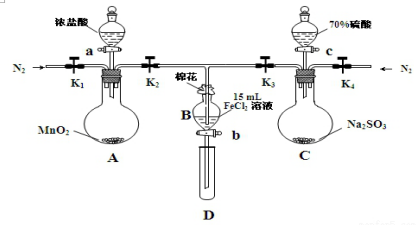
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的酸性增强 | |
| C. | 该反应中NO2-被还原 | |
| D. | H+可以是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3 Ba2++8OH-═3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+02↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O═2Cl-+SO2↑+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含D的盐溶液一定显酸性 | |
| B. | 可电解熔融DE3冶炼D单质 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 1 mol 由元素A、B组成的化合物可能含有18 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1ml,加水稀释至100ml后,溶液pH降低2个单位 | |
| B. | 0.2molCO2通入1L0.3mol•L-1 KOH溶液中:2 c(H+)+c(HCO3-)+3c(H2CO3)=2 c(OH-)+2c(CO32-) | |
| C. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中的c(Na+):①<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH-)=10-14的溶液 | B. | pH=7的溶液 | ||
| C. | c(H+)=c(OH-)的溶液 | D. | 使石蕊溶液呈紫色的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.5NA个氯气分子所占体积约是11.2 L | |
| B. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| C. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com