

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制500mL 4.6mol/L的稀硫酸需取该硫酸125mL | |
| C. | 1mol Cu与足量的该硫酸反应产生2g氢气 | |
| D. | 等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2mol/L |
分析 A.根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.根据溶液稀释前后溶质的物质的量不变分析;
C.铜与浓硫酸加热反应生成二氧化硫,不会生成氢气;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此进行判断.
解答 解:A.该硫酸溶液的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.设配制500mL4.6mol•L-1的稀硫酸需取该硫酸的体积为xL,配制的溶液为500mL 4.6mol/L的稀硫酸,根据溶液稀释前后溶质的物质的量不变可知:0.5L×4.6mol/L=x×18.4mol/L,解得:x=0.125L=125mL,故B正确;
C.铜在浓硫酸中加热反应生成的是SO2,不生成氢气,故C错误;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
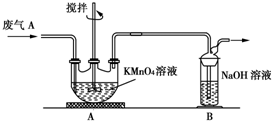 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.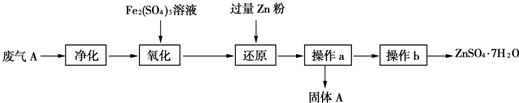
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH | D. |  → → |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com