
 大的试管中加入的固体试剂是________,当反应结束时,A、B两试管中消耗的HCl的质量之比为__________。实验过程中我们还能感受到Na2CO3与盐酸反应是放热反应,而NaHCO3与盐酸反应是吸热反应。在A、B两试管中的反应过程中,反应体系的能量变化的总趋势分别对应于下面中的_________、_________。(填“a”或“b”)
大的试管中加入的固体试剂是________,当反应结束时,A、B两试管中消耗的HCl的质量之比为__________。实验过程中我们还能感受到Na2CO3与盐酸反应是放热反应,而NaHCO3与盐酸反应是吸热反应。在A、B两试管中的反应过程中,反应体系的能量变化的总趋势分别对应于下面中的_________、_________。(填“a”或“b”)
科目:高中化学 来源: 题型:阅读理解
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.| 11 |
| 3 |
| 11 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| [H2][CO] |
| [H2O] |
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
| 0.2×0.4 |
| 0.1 |
| 0.2×0.4 |
| 0.1 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省等五校高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是???????? 。
A.体系的密度不发生变化???? ????????????? ? B.SO2与SO3的体积比保持不变
C.体系中硫元素的质量百分含量不再变化??? ?? D.单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 ????? ? ? 图2?? ???? ? 图3
①该反应的平衡常数表达式为?????????? ,升高温度,平衡常数????????? (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=??????? ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为??????? (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ????? 点,温度T1 ?? T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈???? 性,所得溶液中c(H+)- c(OH-)=??????????? (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
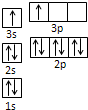
⑴基态Fe3+的核外电子排布式为 ▲ 。C、N、O三种元素的第一电离能由大到小的顺序是 ▲ 。
⑵尿素分子中C、N原子的杂化方式分别是 ▲ 。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 ▲ 。与NO3—互为等电子体的一种化合物是 ▲ (写化学式)。
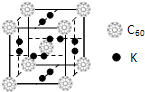
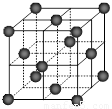
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
② 1个CO2分子周围等距离且距离最近的CO2分子有 ▲ 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 ▲ 。
B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为:

实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
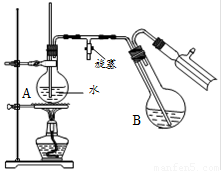
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。
步骤①中加入沸石的目的是 ▲ 。
步骤②中,在60~70min内低温加热的目的是 ▲ ,然后大火加热蒸出乙醇的目的是 ▲ 。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是 ▲ ,玻璃管的作用是 ▲ 。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com