
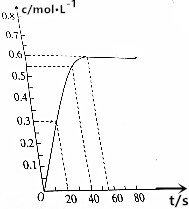
 298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.
298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.分析 由图可知,达到平衡时N2O4的浓度为0.6mol/L,达到平衡时N2O4的浓度为NO2的2倍,NO2的浓度为0.3mol/L,则
2NO2(g)?N2O4(g)
平衡 0.3 0.6
转化 1.2 0.6
开始 1.5 0.6
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%.
解答 解:由图可知,达到平衡时N2O4的浓度为0.6mol/L,达到平衡时N2O4的浓度为NO2的2倍,NO2的浓度为0.3mol/L,则
2NO2(g)?N2O4(g)
平衡 0.3 0.6
转化 1.2 0.6
开始 1.5 0.6
(1)达到平衡时,N2O4的物质的量浓度为0.6mol/L,NO2的物质的量为0.3mol/L×2L=0.6mol,故答案为:0.6mol/L;0.6;
(2)298K时,0~20s内,N2O4的物质的量浓度为0.3mol/L,则v(N2O4)=$\frac{0.3mol/L}{20s}$=0.015mol/(L.s),由速率之比等于化学计量数之比可知NO2的平均反应速率为0.015mol/(L.s)×2=0.03mol/(L.s),故答案为:0.03mol/(L.s);
(3)该反应中NO2的平衡转化率为$\frac{1.2}{1.5}$×100%=80%,故答案为:80%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意速率之比等于化学计量数之比,题目难度不大.


科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该气体的物质的量为m/M mol | |
| B. | 该气体在标准状况下的体积为22.4m/M L | |
| C. | 该气体中所含的原子总数为mNA/M个 | |
| D. | 该气体溶于1L水中(不考虑发生反应),所得溶液的物质的量浓度为m/M mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 还原性:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸粘到皮肤上立即用稀氢氧化钠溶液冲洗 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 金属钠着火时,立即用砂子灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11% | B. | 19% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月饼中放置用小袋包装的生石灰防止月饼氧化变质 | |
| B. | 用米汤来检验食用碘盐中的碘酸钾(KIO3) | |
| C. | 甘蔗可变成酒精 | |
| D. | 用催化剂将水变成油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
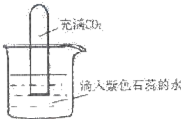 如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com