
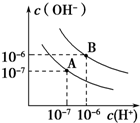
 ��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��
��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ������ ��1��ˮ�ĵ��������ȹ��̣������¶�����ˮ���룬����ˮ��c��H+����c��OH-������С��
��2���ȸ����¶Ⱥͻ����ҺpH��Сȷ����Һ������ԣ�������Һ��pH������ͼ�����֮�ȣ�
��3��95��ʱ��ˮ��Һ���ӻ�����Kw=10-12��0.1mol•L-1��NaOH��Һ������������Ũ��Ϊ0.1mol/L������õ���Һ��������Ũ�ȵõ���Һ��pH��
��4���ᡢ���ǿ����ʣ���Һ������˵�������Ӻ����������ӵ����ʵ�����ȣ����ˮ�����ӻ�����ȷ��ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��
��� �⣺��1��ˮ�ĵ��������ȹ��̣������¶ȣ�ʹˮ�ĵ���̶������¶�����ʱ���ٽ�ˮ�ĵ��룬ˮ�����ӻ�����ˮ�������ӡ�����������Ũ�ȶ�����ˮ��pH��С������Һ��Ȼ�����ԣ���25��ʱˮ�ĵ���ƽ������ӦΪA��
�ʴ�Ϊ��A����
��2��25��Cʱ��ˮ��pH=7�������Һ��pH=7��˵���ᡢ����ʱǡ����ȫ�кͣ�pH=8��NaOH��Һc��OH-��=10-6 mol/L��pH=5��H2SO4��Һ��H+��=10-5mol/L��
�������Ϊx��������Ϊy��
10-6 mol/L��x=10-5mol/L��y
x��y=10��1��
�ʴ�Ϊ��10��1��
��3��95��ʱ��ˮ��Һ���ӻ�����Kw=10-12��0.1mol•L-1��NaOH��Һ������������Ũ��Ϊ0.1mol/L������õ���Һ��������Ũ��c��H+��=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L���õ���Һ��pH=-lg10-11mol/L=11��
�ʴ�Ϊ��11��
��4��Ҫע�����95��Cʱ��ˮ�����ӻ�Ϊ10-12�����ᡢ��Ũ�����ʱpH���ᣩ+pH���=12����ǿ���OH-Ũ����ǿ��H+Ũ�ȵ�100��������pH���ᣩ+pH���=14����pH1+pH2=14���õ�a+b=14��
�ʴ�Ϊ��a+b=14��
���� ���⿼��ˮ�ĵ�����ᡢ���ϵ�pH�������⣬�ѶȽϴ�ע���¶Ȳ�ͬ��ʹˮ�����ӻ�������ͬ�ǽⱾ��Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ����һ�ֵ��� | B�� | �����ǻ����� | ||
| C�� | һ���Ǵ����� | D�� | �����Ǵ����Ҳ�����ǻ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.01mol/L CH3COOH��Һ | B�� | 0.01mol/L HNO3��Һ | ||
| C�� | pH=2��H2SO4��Һ | D�� | pH=2��CH3COOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
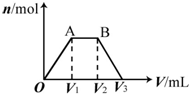 ��KOH��Ca��OH��2�Ļ����Һ��pH=13��ȡ����Һ500mL��������ͨ��CO2��ͨ��CO2�������V�������ɳ��������ʵ�����n���Ĺ�ϵ��ͼ��ʾ��ͼ�У�V1��Ϊ112mL����״��������ͼ��V2��V3���������λΪmL���ֱ��ǣ�������
��KOH��Ca��OH��2�Ļ����Һ��pH=13��ȡ����Һ500mL��������ͨ��CO2��ͨ��CO2�������V�������ɳ��������ʵ�����n���Ĺ�ϵ��ͼ��ʾ��ͼ�У�V1��Ϊ112mL����״��������ͼ��V2��V3���������λΪmL���ֱ��ǣ�������| A�� | 560��672 | B�� | 1008��1120 | C�� | 2240��2352 | D�� | 392��504 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
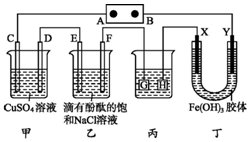 ��ͼװ����ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ��F�������ʺ�ɫ��
��ͼװ����ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ��F�������ʺ�ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
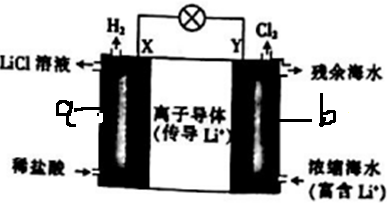
| A�� | ��ع���ʱ��Li+ͨ�����ӵ�������b�� | |
| B�� | ������X��ͨ����·����Y�� | |
| C�� | ���������ķ�ӦΪ2H++2e-�TH2�� | |
| D�� | Y��ÿ����1molCl2��a���õ�2molLiCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com