
| A. | NO、O2、NO2分子数目比是2:1:2 | |
| B. | 反应混合物中各组分物质的浓度相等 | |
| C. | 混合气体的总质量不变 | |
| D. | 混合气体的平均相对分子质量不变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、NO、O2、NO2分子数目比是2:1:2的状态,不能体现各组分的浓度不变,故A错误;
B、达平衡状态时反应混合物中各组分物质的浓度不变,而不是相等,故B错误;
C、混合气体的总质量一直不变,故C错误;
D、混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 0 g | B. | 32 g | C. | 38.4 g | D. | 48 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
. ,其现象为酸性高锰酸钾溶液褪色.
,其现象为酸性高锰酸钾溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
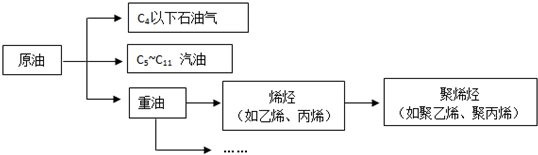
 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: ;B的最高价氧化物对应水化物的化学式为H2SO4.
;B的最高价氧化物对应水化物的化学式为H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
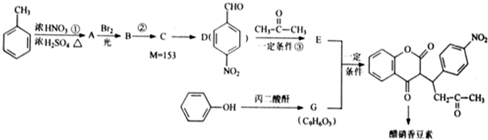
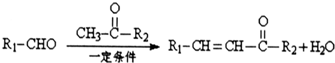
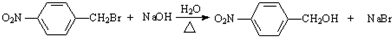 .
. .
.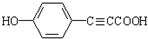 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的生成与水的电解是可逆反应 | |
| B. | 实验室用H2O2制O2,加入MnO2后,反应速率明显加快 | |
| C. | 反应2SO2+O2═2SO3中,可以通过改变反应条件让SO2、O2完全转化为SO3 | |
| D. | 金属钠与足量水反应,增加水的量能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
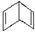
| A. | 乙烯、溴苯分子中的所有原子均共平面 | |
| B. | 在有机物分子中,含有的氢原子个数一定是偶数 | |
| C. | 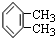 与 与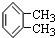 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 | |
| D. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com