
【题目】化学反应方程式是化学学习的基本工具,本学期在化学反应速率与化学平衡章节学过几个重要的方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:________________。
(2)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:________________。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物A的结构为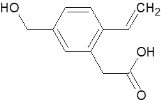 , 下列有关说法正确的是
, 下列有关说法正确的是
A. 1 mol A能跟2 mol NaOH溶液反应
B. 能发生加聚反应
C. 不能发生分子内酯化反应
D. A分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
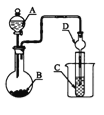
A. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
B. 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
D. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下合成氨反应:N2 +3 H2![]() 2 NH3 ΔH=—92.4 kJ/ mol,在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
2 NH3 ΔH=—92.4 kJ/ mol,在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
A. Q2 =2Q1=184.8kJ B. Q1 < 0.5 Q2 C. Q1 < Q2 < 184.8 kJ D. Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
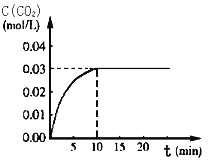
(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
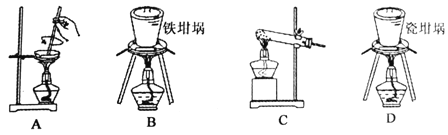
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
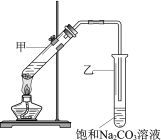
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在容积不变的密闭容器中发生如下可逆反应:2M(g)+N(g) ![]() 2E(g),若开始只充入2 mol E(g),达到平衡时,E的转化率为40%;若开始时充入2mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始只充入2 mol E(g),达到平衡时,E的转化率为40%;若开始时充入2mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A. 20% B. 40% C. 60% D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com