
【题目】阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
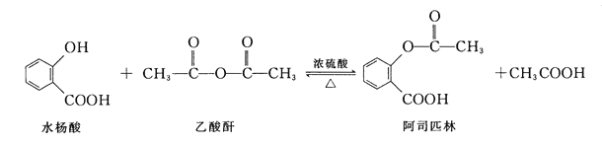
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
【答案】D
【解析】
A.苯环为平面结构,氧氢单键可以旋转,所以酚羟基可以与苯环共面,碳氧双键为平面结构,羟基可以与其共面,碳氧双键平面与苯环平面以单键相连,单键可以旋转,所以水杨酸分子中所有原子可能共面,故A正确;
B.苯环上的两个取代基可以为—OH和—COOH,则有邻间对三种,水杨酸即为邻位的情况,两个取代基还可以是—OH和—OOCH,有邻间对三种,所以除水杨酸外还有5种,故B正确;
C.乙酰水杨酸含有苯环,可以发生加成反应;含有酯基,可以发生水解反应;含有羧基,可以发生酯化反应,故C正确;
D.乙酰水杨酸含羧基,可以和碳酸钠溶液发生反应,所以不能用碳酸钠溶液分离乙酰水杨酸和乙酸,故D错误;
答案为D。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
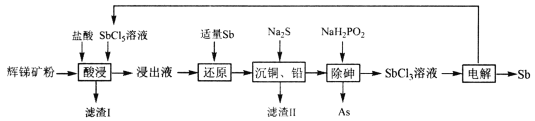
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,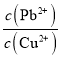 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
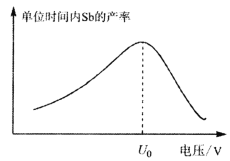
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒给世界人民的生活和工作带来严重威胁。医用酒精、过氧乙酸![]() 、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
、84消毒液均可有效杀灭新型冠状病毒。下列有关这三种消毒剂的说法正确的是( )
A.酒精浓度越高杀灭病毒效果越好
B.杀灭病毒原理相同
C.过氧乙酸中含有过氧键
D.酒精和84消毒液混合施用效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是重要的战略物资,2016年我国江西省发现超大型钨矿,再次刷新钨矿储量的世界纪录。由钨铁矿(主要成分是![]() ,还含有少量
,还含有少量![]() )制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
)制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
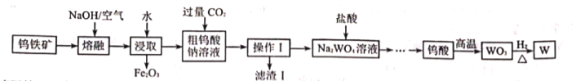
请回答下列有关问题:
(1)浸取后进行的分离操作的名称是________。
(2)滤渣![]() 的主要成分是________(填化学式),写出生成该物质的离子方程式________。
的主要成分是________(填化学式),写出生成该物质的离子方程式________。
(3)已知![]() 中铁元素的化合价为+2价,
中铁元素的化合价为+2价,![]() 在熔融过程中发生反应的化学方程式为________。
在熔融过程中发生反应的化学方程式为________。
(4)在![]() 溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
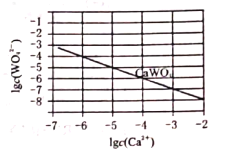
(5)如图为![]() 在常温下的沉淀溶解平衡曲线,若将
在常温下的沉淀溶解平衡曲线,若将![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液按体积比2:1混合,要产生
溶液按体积比2:1混合,要产生![]() 沉淀,则
沉淀,则![]() ________。(忽略溶液体积变化)
________。(忽略溶液体积变化)
(6)用碳化钨![]() 作阳极,不锈钢作阴极,
作阳极,不锈钢作阴极,![]() 溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出
溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出![]() ,则阳极反应式为________;若在标准状况下放出
,则阳极反应式为________;若在标准状况下放出![]() ,则阳极增重的质量为________
,则阳极增重的质量为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献,![]() 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________形。
(2)![]() 中
中![]() 的配位数为4。
的配位数为4。
①配体中![]() 原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
②![]() 的立体构型是________;与
的立体构型是________;与![]() 互为等电子体的分子和离子为________(各写一种)。
互为等电子体的分子和离子为________(各写一种)。
(3)![]() 是钴的重要化合物。
是钴的重要化合物。![]() 键角小于
键角小于![]() 的键角,原因是________。
的键角,原因是________。
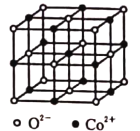
(4)一氧化钴的晶胞如图所示,在每个![]() 的周围与它距离最近的
的周围与它距离最近的![]() 共有________个,若
共有________个,若![]() 晶体的密度为
晶体的密度为![]() ,则晶体中
,则晶体中![]() 与
与![]() 之间的最小距离为________
之间的最小距离为________![]() 。(用含
。(用含![]() 和
和![]() 的代数式表示。
的代数式表示。![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
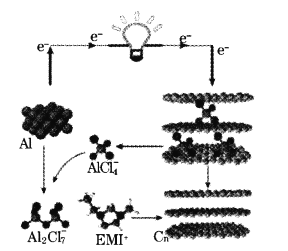
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
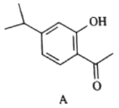
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
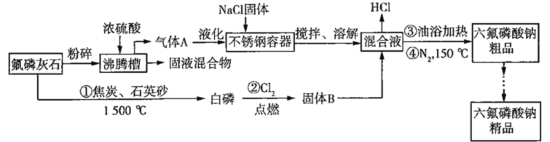
已知:HF的熔点为-83 ℃,沸点为19.5 ℃。回答下列问题:
(1)氟磷灰石粉碎的目的是_______________。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式:________。
(3)为避免废水NaH2PO4的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水c(Ca2+)=1.0×10-5 mol/L时,则溶液中c(![]() )=___________mol/L。
)=___________mol/L。
(4)操作③油浴加热目的是________。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式:______。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过______(填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,正确的是( )

A.常温下水很稳定(1000℃以上才会部分分解),因为水中含有大量氢键
B.![]() 该分子含有1个手性碳原子
该分子含有1个手性碳原子
C.含有极性键的分子一定是极性分子
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com