
【题目】硫代硫酸钠是无色透明的晶体,易溶于水,其水溶液显碱性。在漂白工业中用作“脱氯剂”,常用黄铁矿(主要成分是![]() )经以下流程来制备硫代硫酸钠
)经以下流程来制备硫代硫酸钠
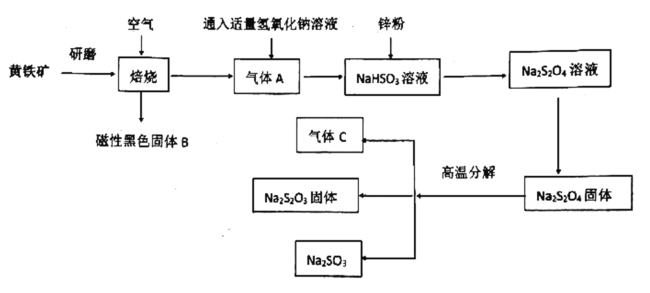
已知:气体C可以使品红溶液褪色
(1)研磨的目的是:____________,磁性黑色固体B的化学式为:________。
(2)尾气C能否用氢氧化钙溶液吸收:________(填“能”或“不能”),原因是:
________________。
(3)写出![]() 固体高温分解反应方程式:__________________________。
固体高温分解反应方程式:__________________________。
(4)![]() 溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
____________________。
(5)请用“<”符号表示出亚硫酸氢钠溶液中的各离子浓度大小关系:____________。
(6)硫代硫酸钠在漂白工业中用作“脱氯剂”,标准状况下当消耗31.6g硫代硫酸钠时吸收氯气的积为:________L。
(7)已知![]() 溶液中
溶液中![]() ,求
,求![]() 的比值________(已知:
的比值________(已知:![]() 溶液的一级电离常数为
溶液的一级电离常数为![]() ,二级电离常数为
,二级电离常数为![]() ,水的电离常数为
,水的电离常数为![]() ,请用含有
,请用含有![]() 、
、![]() 、
、![]() 、b的式子表示)。
、b的式子表示)。
【答案】增大表面积加快反应速率 ![]() 不能 氢氧化钙在水中的溶解度小,溶液浓度低,单位体积的氢氧化钙溶液吸收
不能 氢氧化钙在水中的溶解度小,溶液浓度低,单位体积的氢氧化钙溶液吸收![]() 能力弱
能力弱 ![]()
![]()
![]() 17.92L
17.92L 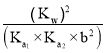
【解析】
将主要成分是![]() 的黄铁矿在空气中焙烧后得到四氧化三铁和二氧化硫,将二氧化硫与适量氢氧化钠溶液反应得到亚硫酸氢钠溶液,再加入锌粉得到
的黄铁矿在空气中焙烧后得到四氧化三铁和二氧化硫,将二氧化硫与适量氢氧化钠溶液反应得到亚硫酸氢钠溶液,再加入锌粉得到![]() 溶液,经过蒸发结晶得到
溶液,经过蒸发结晶得到![]() 固体,将
固体,将![]() 固体高温分解得到
固体高温分解得到![]() 、
、![]() 和二氧化硫,据此分析。
和二氧化硫,据此分析。
(1)研磨的目的是增大表面积,加快反应速率;根据流程可知,磁性黑色固体B是四氧化三铁,化学式![]() ;
;
(2)氢氧化钙在水中的溶解度小,溶液浓度低,单位体积的氢氧化钙溶液吸收![]() 能力弱,故不能用强氧化钙溶液吸收二氧化硫气体;
能力弱,故不能用强氧化钙溶液吸收二氧化硫气体;
(3)根据题目信息固体高温分解生成![]() 、
、![]() 和二氧化硫,写出反应方程式,并配平:
和二氧化硫,写出反应方程式,并配平:![]() ;
;
(4)酸性条件下硫代硫酸根发生歧化反应生成硫单质、二氧化硫和水, ![]() ,故
,故![]() 溶液与盐酸不能稳定存在;
溶液与盐酸不能稳定存在;
(5) 亚硫酸氢根要电离,故浓度小于钠离子的浓度,它电离出氢离子和亚硫酸根离子,故氢离子浓度小于亚硫酸氢根离子,亚硫酸氢钠溶液中的亚硫酸氢根电离程度大于水解程度,溶液呈酸性,氢离子浓度大于氢氧根离子浓度,由于水要电离出氢离子和氢氧根离子,氢离子浓度大于亚硫酸根离子;各离子浓度的大小关系为:![]() ;
;
(6)硫代硫酸钠在漂白工业中用作“脱氯剂”,![]() 的硫化合价被氯气从+2价氧化到+6价,氯气中氯的化合价从0价还原到-1价,反应的对应关系1mol
的硫化合价被氯气从+2价氧化到+6价,氯气中氯的化合价从0价还原到-1价,反应的对应关系1mol![]() 对应4mol的Cl2,31.6g硫代硫酸钠的物质的量
对应4mol的Cl2,31.6g硫代硫酸钠的物质的量![]() ,吸收氯气的物质的量为0.8mol,标下的体积为
,吸收氯气的物质的量为0.8mol,标下的体积为![]() ;
;
(7)亚硫酸的电离分两步进行:![]() ,
,![]() ;
;
![]() ,
,![]() ;
;
亚硫酸钠溶液中亚硫酸根分两步水解:
![]() ;
;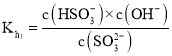 ;
;
![]() ,
,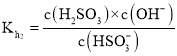 ;
;
两级水解常数相乘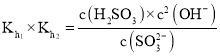 ,由
,由![]() ,
,![]() ,
,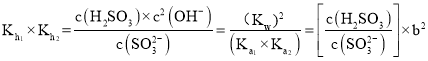 ,进行转换得到:
,进行转换得到: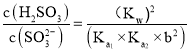 。
。


科目:高中化学 来源: 题型:
【题目】2,6-二甲基苯氧乙酸是合成抗新型冠状病毒药物洛匹那韦的原料之一,其结构简式如图所示,有关2,6-二甲基苯氧乙酸说法正确的是( )
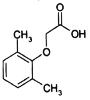
A.该分子所有原子可能处于同一平面B.该分子苯环上一氯代物有3种
C.该分子能使酸性高锰酸钾溶液褪色D.该分子与苯甲酸互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O (相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
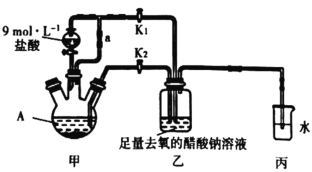
①________________________________________。
②往装置A中依次加入过量锌粒、适量CrCl3溶液。
③关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
④待A内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中混合物快速过滤、洗涤和干燥,称量得到[Cr(CH3COO)2]22H2O。
(1)实验步骤①进行什么操作______________________________。
(2)装置A的名称__________________。
(3)写出装置A中反应的离子方程式为__________________,___________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为__________________。
(5)步骤③目的是_____________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是__________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质12.68g,实验后得干燥纯净的[Cr(CH3COO)2]22H2O 11.28g,则该实验所得产品的产率为_______(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为3mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6mol·L-1·s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下面的能量变化示意图,下列热化学方程式正确的是

A. 2A(g)+ B(g)=2C(g)△H=a(a>0)B. 2A(g)+ B(g)=2C(g)△H=a(a<0)
C. 2A + B=2 C△H=a(a<0)D. 2C=2A +B△H=a(a>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
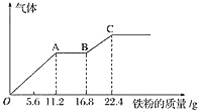
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.4 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
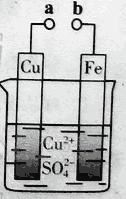
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 分子筛催化剂,
分子筛催化剂,![]() 可脱除燃煤烟气中的
可脱除燃煤烟气中的![]() 和
和![]() ,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
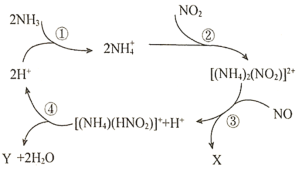
A.X和Y均是![]()
B.上述历程的总反应为:![]()
C.阶段④中氮元素只被还原
D.![]() 、
、![]() 、
、![]() 中的质子数、电子数均相同
中的质子数、电子数均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com