
下列实验中,所采取的分离方法与对应原理都正确的是
选项 | 目的 | 分离方法 | 原理 |
A | 除去KCl中的MnO2 | 蒸发结晶 | 溶解度不同 |
B | 除去碘中的NaCl | 加热、升华 | NaCl的熔点高,碘易升华 |
C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:实验题
实验室需要2.0 mol·L-1NaOH溶液90mL,请回答下列问题:
(1)配制该NaOH溶液时使用的仪器除托盘天平、烧杯、玻璃棒外,还必须用到的仪器有 、 等。
(2)用托盘天平称取氢氧化钠,其质量为 g;
(3)下列主要操作步骤的正确顺序是 (填序号);
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液转移到容量瓶中;
(4)在实验中其他操作均正确,如实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度 (填“偏高”或“偏低”或“不变”);若定容时仰视刻度线,则所得溶液浓度 2.0 mol·L-1(填“大于”或“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:选择题
右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是( )

A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH = -92kJ·mol-1
2NH3(g) ΔH = -92kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂, 该化学反应的活化能和反应热都改变
D.在温度体积一定的条件下, 通入lmol N2和3molH2 反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是: H2>CH4>O2>CO2>SO2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
与50 mL 0.1 mol·L-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是
A、50 mL 0.2 mol·L-1 的 NaCl 溶液 B、100 mL 0.1 mol·L-1 的 NaCl 溶液
C、25 mL 0.2 mol·L-1 的 Na2SO4 溶液 D、10 mL 0.5mol·L-1 的 Na2CO3 溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42-
C.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定Ba2+
D.某溶液中加入氢氧化钠溶液生成蓝色沉淀,一定有Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
下图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1,断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
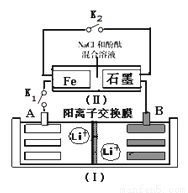
A.闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
B.闭合K1,断开K2时,当0.1 mol Li+从A极区迁移
到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下)
C.取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5 O12 -3e-= Li4Ti5 O12+3 Li+
D.若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第二次月考化学卷(解析版) 题型:填空题
氮化硼(BN)是一种重要的功能陶瓷材料,请回答下列问题:
(1)基态B原子的电子排布式为___________;B和N相比,电负性较大的是_________;
(2)在BF3分子中, B原子的杂化轨道类型为___________; BF3分子的空间构型为_____________;
(3)六方氮化硼在高温高压下,可以转化为立方氮化硼晶胞,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有__________个氮原子、立方氮化硼的密度是___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com