
| A. | 标准状况下2.24L C12溶于水,发生反应转移的电子数一定为0.1NA | |
| B. | 1 mol的羟基(-OH)和l mol的OH-所含电子数均为1NA | |
| C. | 常温常压下,1.6gCH4中含有共价键总数为0.4NA | |
| D. | 室温下,1L 0.1mol•L-1CH3COONH4溶液中NH4+离子数为0.1NA |
分析 A、氯气和水的反应为可逆反应;
B、羟基中含9个电子,氢氧根中含10个电子;
C、求出甲烷的物质的量,然后根据1mol甲烷中含4mol共价键来分析;
D、铵根离子为弱碱阳离子,在溶液中会水解.
解答 解:A、氯气和水的反应为可逆反应,故不能反应完全,则转移的电子数小于0.1NA个,故A错误;
B、羟基中含9个电子,氢氧根中含10个电子,故1mol氢氧根中含10NA个电子,而1mol羟基中含9NA个电子,故B错误;
C、1.6g甲烷的物质的量为0.1mol,而1mol甲烷中含4mol共价键,故0.1mol甲烷中含0.4NA条,故C正确;
D、铵根离子为弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
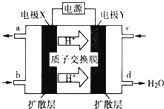 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将气体X通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| B | 向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 表明淀粉没有水解生成葡萄糖 |
| C | 向含有Cl-和SO42-溶液中,加入过量的硝酸化的Ba(NO3)2溶液,过滤,向滤液中再滴加AgNO3溶液 | 有白色沉淀生成 | 证明溶液中有Cl- |
| D | 向盛有5mL0.005mol•L-1 FeCl3溶液的试管中加入5mL0.01mol•L 1KSCN溶液后,再加入4滴0.1mol•L -1KSCN溶液 | 溶液红色加深 | Fe3++3SCN-?Fe(SCN)3可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.秦朝铜车马 | B.春秋越王剑 | C.唐三彩 | D.商代司母戊鼎 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
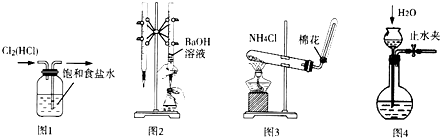
| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
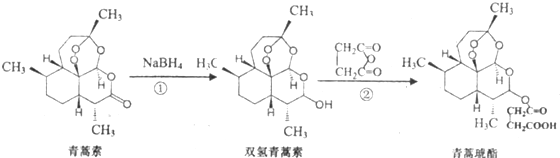
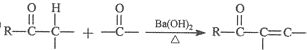
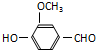 ,有关反应过程如下:
,有关反应过程如下: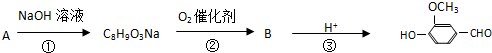
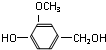 B
B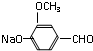 .
.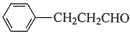 的合成路线流程图.(无机试剂任用,路线流程图示例如下:
的合成路线流程图.(无机试剂任用,路线流程图示例如下: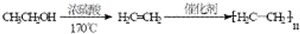
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com