
| △c |
| t |
| 已转化的物质的量 |
| 起始总物质的量 |
| 实际产量 |
| 理论产量 |
| △c |
| t |
| ||
| 2 |
| 已转化的物质的量 |
| 起始总物质的量 |
| 0.9 |
| 1 |
| 实际产量 |
| 理论产量 |
| 0,9 |
| 1 |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来C02的利用日新月异.
近年来C02的利用日新月异.| 0min | 5min | 10min | |
| CO2 | 0.2 | 0.1 | |
| H2 | 0.8 | 0.6 | |
| CH4 | 0 | 0.06 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
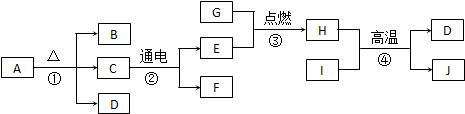
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/0C | 250 | 310 | 350 |
| K/(mol/L)2 | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com