
| A. | 铜与硝酸反应 | B. | 钠与氧气反应 | ||
| C. | 氢气与氯气反应 | D. | 氯化铝与氢氧化钠溶液反应 |
分析 A.铜和浓硝酸反应生成二氧化氮气体,溶液变稀后,和稀硝酸反应生成一氧化氮;
B.钠在氧气中燃烧生成过氧化钠,在空气中放置生成氧化钠;
C.氢气和氯气光照或点燃只生成氯化氢气体;
D.氯化铝溶液中加入氢氧化钠溶液量少会生成氢氧化铝沉淀,氢氧化钠多会使氢氧化铝溶解.
解答 解:A.硝酸溶液浓度不同和铜反应生成产物不同,稀硝酸和铜反应生成一氧化氮,浓硝酸和铜反应生成二氧化氮,故A不选;
B.钠在氧气中燃烧生成过氧化钠,在空气中放置生成氧化钠,产物与反应条件有关,故B不选;
C.氢气和氯气反应生成氯化氢,和反应物用量、浓度或反应条件无关,故C选;
D.NaOH不足时生成氢氧化铝,NaOH足量时生成偏铝酸钠,故D不选;
故选C.
点评 本题综合考查元素化合物知识,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46gNO2和N2O4混合气体中氮原子数为NA | |
| B. | 1mol 14C含有的中子数为6NA | |
| C. | 标准状况下,22.4LCCl4中含有的分子数为NA | |
| D. | 0.5molNa2O2与足量水反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
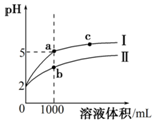 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| A | 纯净物 | 液氯、KAl(SO4)2、CuSO4•5H2O |
| B | 能导电 | Fe、NaCl晶体、AgCl |
| C | 碱 | 一水合氨、NaOH、纯碱 |
| D | 电解质 | 盐酸、硫酸、硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com