
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究新的热点。 完成下列问题:
(1)CO2催化加氢合成CH3OCH3是一种CO2转化方法,其过程中主要发生下列反应:
反应I:![]()
反应Ⅱ:![]()
①写出CO和H2合成CH3OCH3的热化学方程式____。
②分别在2L恒温密闭容器甲(恒温恒容)、乙(恒温恒压)中,加入CO2和H2各1 mol的混合气体,假设只发生反应Ⅱ,则两容器中反应达平衡后放出或吸收的热量较多的是____(填“甲”或“乙”)。当反应5 min时,测得甲容器中压强变为原来的一半,则用CO2表示的反应的速率= ___。
③在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
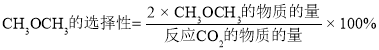
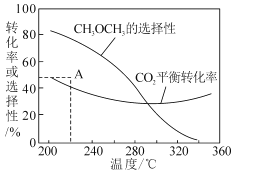
i)温度高于300℃,温度对CO2平衡转化率影响较大的是反应____(填“I”或“Ⅱ”)。
ii)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施可以是____(任答一条)。
(2)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为____(写离子符号);若所得溶液c(HCO3-):c(CO32-)=1:5,溶液pH= ___。(室温下,H2CO3的![]() )
)
【答案】![]() 乙 0.05mol/(L·min) Ⅰ 增大压强或使用对反应Ⅱ催化活性更高的催化剂或其他合理答案 CO32- 11
乙 0.05mol/(L·min) Ⅰ 增大压强或使用对反应Ⅱ催化活性更高的催化剂或其他合理答案 CO32- 11
【解析】
(1)①先写出CO和H2反应的方程式,该反应方程式为2CO+4H2=CH3OCH3+H2O,然后根据盖斯定律进行分析;
②根据方程式的特点和压强对化学平衡的影响分析;压强变为一半,在相同的条件下,压强之比等于物质的量之比,即气体物质的量变为原来的一半,然后进行分析;
③i)根据图像,温度高于300℃时,CH3OCH3的选择性迅速降低,而CO2的平衡转化率增大,据此分析;
ii)增大CH3OCH3选择性,即增大CH3OCH3的物质的量,不改变反应时间和温度,反应向正反应方向进行或加快反应速率,据此分析;
(2)CO2与NaOH反应,产物可能是Na2CO3,也可能是NaHCO3,也可能是两者的混合物,需要根据碳酸的二级电离平衡常数进行分析和对比;
(1) ①CO和H2反应的方程式为2CO+4H2=CH3OCH3+H2O,根据盖斯定律,将反应II-2×反应I,2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) △H=-204.9kJ·mol-1;
②反应II是气体物质的量减小的反应,随着反应的进行,恒温恒容容器内的气体压强减小,恒温恒压相当于在恒温恒容基础上增大压强,增大压强,该反应向正反应方向进行,放出的热量增多,即乙容器放出的热量较多;甲容器为恒温恒容,5min时甲容器内的压强变为原来的一半,则气体物质的量变为原来的一半,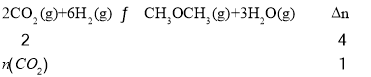 ,解得n(CO2)=0.5mol,根据化学反应速率的表达式为υ(CO2)=
,解得n(CO2)=0.5mol,根据化学反应速率的表达式为υ(CO2)=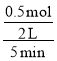 =0.05mol/(L·min);
=0.05mol/(L·min);
③i)根据图像,温度高于300℃时,CH3OCH3的选择性迅速降低,反应II向逆反应方向进行,CO2的转化率降低;反应I是吸热反应,升高温度,平衡向正反应方向反应,CO2的转化率增大,根据图像,温度高于300℃时,CO2的平衡转化率增大,说明温度对CO2平衡转化率影响较大的是反应I;
ii)在不改变时间和温度情况下,一定能提高CH3OCH3选择性措施的是增大压强或使用对反应II催化活性更高的催化剂;
(2)Ka2=![]() ,所得溶液的pH=13,即c(H+)=10-13mol·L-1,
,所得溶液的pH=13,即c(H+)=10-13mol·L-1, ![]() =5×10-11,
=5×10-11,![]() =500,c(CO32-)>c(HCO3-),CO2主要转化为CO32-;所得溶液c(HCO3-):c(CO32-)=1:5,代入Ka2=
=500,c(CO32-)>c(HCO3-),CO2主要转化为CO32-;所得溶液c(HCO3-):c(CO32-)=1:5,代入Ka2=![]() =5×10-11,
=5×10-11,![]() =5×10-11,c(H+)=1×10-11mol·L-1,即此时溶液的pH=11。
=5×10-11,c(H+)=1×10-11mol·L-1,即此时溶液的pH=11。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol(反应热)
SO2(g) ΔH=269.8kJ/mol(反应热)
D.Fe+S![]() FeS ΔH=95.6kJ/mol(反应热)
FeS ΔH=95.6kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制0.500 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、__________、_______.
(2)本实验须称量碳酸钠晶体(Na2CO310H2O)________g。
(3)①如果定容时仰视会导致溶液浓度__________(填“偏高”、“偏低”或“无影响” 下同);
②容量瓶未经干燥就用来配制该溶液,会导致溶液浓度_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A.1molNH4+所含电子数为10NA
B..5.6LCO2中含有的分子数为0.25NA
C.1.2gMg与足量稀硫酸反应,转移的电子数为0.1NA
D.常温常压下,32gO2和O3的混合气体所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知: ,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
II.叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
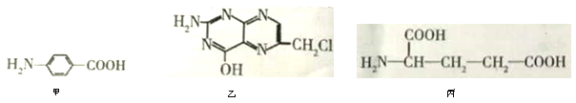
(1)甲中显酸性的官能团是______________(填名称)。
(2)下列关于乙的说法正确的是__________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,了的结构简式为______________.
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,也是化学实验室里必备的重要试剂。除了具有酸的通性以外,还具有一些特殊的性质。
Ⅰ.镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目___。
(2)该反应中氧化剂与还原剂的物质的量之比为___。
(3)还原产物是__。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为__。
Ⅱ.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应的产物之一。写出反应的化学方程式__(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)磷酸钠(Na3PO4)在水溶液中的电离方程式为__ 。
(2)镁条在氮气中燃烧的化学方程式为___。
(3)过氧化钠与水反应的化学方程式为___。该反应中,氧化剂是___,还原剂是___。
(4)浓硫酸和碳在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:
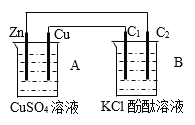
(1)判断装置的名称:A池为__________________;B池为________________;
(2)锌极为___________极,电极反应式__________;
(3)石墨棒C1为________极,电极反应式为_____;石墨棒C2附近发生的实验现象为_____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com