
| A. | 都是银白色的质软金属,密度都很小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质与水剧烈反应生成碱和H2 | |
| D. | 单质熔沸点随着原子序数的增加而升高 |
分析 A.铯是金黄色金属;
B.锂在氧气中燃烧生成氧化锂;
C.碱金属单质都能与水反应生成碱和氢气;
D.金属熔沸点与金属键强弱有关,碱金属从上到下金属键逐渐减弱.
解答 解:A.碱金属中除Cs略带金黄色外,其余都是银白色的柔软金属,Rb和Cs的密度大于水,其余密度都比较小,故A错误;
B.单质在空气中燃烧生成的不一定都是过氧化物,例如Li只能生成氧化锂,故B错误;
C.碱金属单质都能与水反应生成碱和氢气,故C正确;
D.金属熔沸点与金属键强弱有关,碱金属从上到下金属键逐渐减弱,所以熔沸点逐渐降低,故D错误;
故选:C.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律,明确决定金属晶体熔沸点高低因素是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题
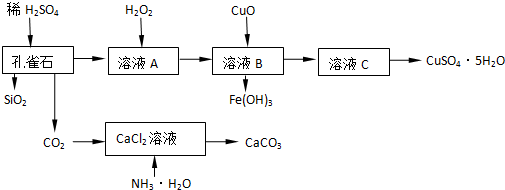
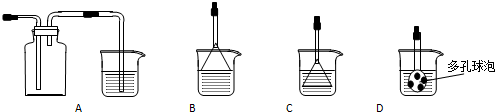
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 木条复燃是因为硝酸铜分解产生了CuO催化作用的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ;它的一种同素异形体是O3.(写化学式)
;它的一种同素异形体是O3.(写化学式)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 再通入$\frac{W}{10}$g氯化氢 | B. | B、蒸发浓缩成$\frac{W}{2}$g | ||
| C. | 蒸发掉溶剂的一半 | D. | 再加入2Wg25%盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它是一种共价化合物 | B. | 在加热时此化合物可以分解 | ||
| C. | 这种化合物不能跟碱发生反应 | D. | 该化合物可以由PH3跟HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com