
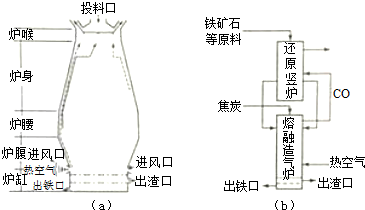
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:石灰石;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)△H=(+494kJ•mol-1)+3×(-283kJ•mol-1)=-355kJ•mol-1,
因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应,
故答案为:-355;②③;①;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:碱液或氢氧化钠、氨水.
点评 本题为2015年海南考题,涉及高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 向蛋白质溶液中加入CuSO4溶液,蛋白质发生变性 | |
| B. | 一定条件下,乙醇能被氧化成一种刺激性气味的液体 | |
| C. | 用Cl2和NaOH溶液为原料制备次氯酸钠 | |
| D. | 海水提溴和生产玻璃过程中均涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共有电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| D. | 通过化学变化可以直接将水转变为汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com