
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
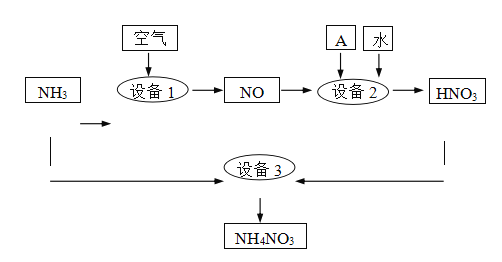
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:
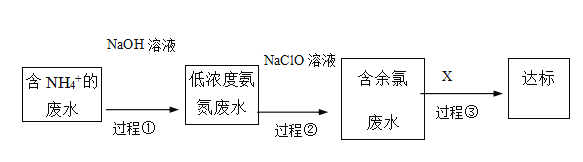
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
【答案】2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O 4NH3+5O2 ==== 4NO+6H2O HNO3+ NH3=NH4NO3 O2或者空气 NH4++OH-= NH3↑+H2O N2 NaCl b SO32-+ClO-= SO42-+Cl-或者SO32-+HClO= SO42-+Cl-+H+
【解析】
I.(1)实验室用NH4Cl和Ca(OH)2制备氨气,其反应的化学方程式为:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O。答案:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O。
II.(2)设备1中是NH3和O2发生反应,化学方程式为4NH3+5O2 ==== 4NO+6H2O;设备II中是HNO3和NH3发生反应,发生反应的化学方程式是HNO3+ NH3=NH4NO3 。设备2中发生的反应为:4NO+O2+H2O=4 HNO3,所以通入的物质A是O2或者空气。答案:4NH3+5O2 ==== 4NO+6H2O;HNO3+ NH3=NH4NO3;O2或者空气。
III.(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,使NH4+转化为NH3,反应的离子方程式为:NH4++OH-= NH3↑+H2O 。答案:NH4++OH-= NH3↑+H2O。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应的方程式为:3NaClO+ 2NH3=3NaCl+N2![]() +3H2O,所以含氮元素、氯元素的物质化学式为N2 、NaCl 。 答案:N2 ;NaCl。
+3H2O,所以含氮元素、氯元素的物质化学式为N2 、NaCl 。 答案:N2 ;NaCl。
(5)含余氯废水的主要成分是NaClO和HClO,要除去需加入还原性物质Na2SO3 ,反应的离子方程式为:SO32-+ClO-= SO42-+Cl-和SO32-+HClO= SO42-+Cl-+H+。答案:b;SO32-+ClO-= SO42-+Cl-或SO32-+HClO= SO42-+Cl-+H+。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】已知:①有机物X的相对分子质量小于180,其中氧的质量分数约为49.4%,②1molX在稀硫酸中发生水解反应生成2mol甲醇和1molA,③X中没有支链。④有机物X、A物质能发生如下图转化关系,E为高分子的化合物,B为环状结构。
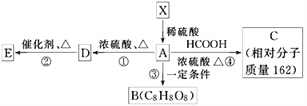
根据以上信息填写下列空白:
(1)1个X分子中,含有________个氧原子,X不可能发生的反应有________(填序号)。
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
(2)写出①的反应类型_______,A分子中的官能团是(写名称)________________。
(3)写出④的化学方程式________________________________________。
(4)有机物“C8H8O8”因分子组成中含有三个国人心目中的吉利数字“8”而被称为“吉利分子”。由A转化而生成的“吉利分子”有多种不同的环状结构,写出符合条件的有机物B有__________种结构,其中的含一个六元环的有机物B结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
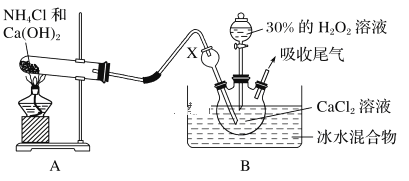
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH)都增大的是( )
A. 加入少量H2O B. 加入少量HCl气体 C. 加入少量NaOH固体 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)________
(2)溶液中共有________ 种不同的微粒。
(3)这些微粒中浓度为0.01 mol·L-1的是_____,浓度为0.002 mol·L-1的是___。
(4)______和_______两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是:____________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
(3)滴定终点的现象是________________________________________。
(4)检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
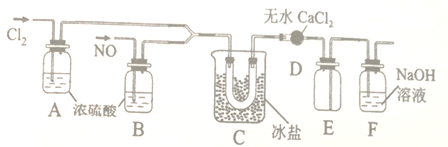
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与浓硫酸反应的实验说法不正确的是

A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com