
分析 某固定容积的2L密闭容器中,起始加入的N2、H2、NH3均为2mol,5min后H2的物质的量为0.5mol,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):2 2 2
变化(mol):0.5 1.5 1
5min后(mol):1.5 0.5 3
根据v=$\frac{△c}{△t}$计算v(N2),根据c=$\frac{n}{V}$计算5min后NH3的物质的量浓度.
解答 解:某固定容积的2L密闭容器中,起始加入的N2、H2、NH3均为2mol,5min后H2的物质的量为0.5mol,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):2 2 2
变化(mol):0.5 1.5 1
5min后(mol):1.5 0.5 3
(1)5min内用N2来表示该反应的反应速率v(N2)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
答:5min内用N2来表示该反应的反应速为0.05mol/(L.min);
(2)5min后NH3的物质的量浓度为$\frac{3mol}{2L}$=1.5mol/L,
答:5min后NH3的物质的量浓度为1.5mol/L;
(3)气体的物质的量减少:(2+2+2)mol-(1.5+0.5+3)mol=1mol,
答:气体的物质的量减少1mol.
点评 本题考查化学平衡计算、反应速率计算,比较基础,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 可用洁净的铁丝代替铂丝进行焰色反应 | |
| B. | 焰色反应是金属单质的特性 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 氯化钠在火焰上灼烧时火焰呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
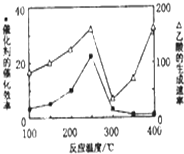 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
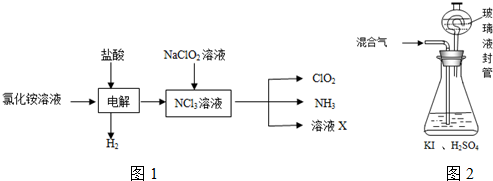
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. |  用排气法收集氯气 用排气法收集氯气 | |
| D. |  分离互不相溶的两种液体 分离互不相溶的两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com