
盐是一类常见物质,下列物质可直接反应生成盐的组合是
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A 只有①③,③④ B只有①④,①⑥
C 只有②⑤,②⑥ D全部均可
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

①设计甲装置的目的是_________________。甲装置__________(填“能”或“不能”)用乙装置来代替。
②装置乙中盛有的液体是__________,该装置可看作是一个___________(填某仪器名称)。
(2)在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。NaNO2是一种潜在的致癌物质,过量或长期使用会对人产生危害。由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐使用的事件。已知:HNO2是一种弱酸,不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2;AgNO2是一种难溶于水易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白中应含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_____________。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
②下列说法中,能用来区别NaNO2和NaCl的是______________。
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
③把新制氯气通入到NaNO2溶液中,氯水褪色,生成NaNO3和HCl,请写出此反应的离子方程式______________。
④为了测定某样品中NaNO2的含量,可以使用标准?KMnO4?溶液进行滴定,试回答:KMnO4溶液在滴定过程中作____________(填“氧化剂”或“还原剂”),该滴定过程_____________(填“要”或“不要”)另加指示剂。
⑤已知HNO2的酸性比醋酸略强,某同学在家中进行鉴别NaNO2与NaCl的实验,但他家中只有浓醋酸,请问该实验能否成功?____________(填“能”或“不能”),请说明理由_______
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
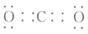
(1)A的化学式是__________________________,
H的电子式是________________________。
(2)反应②的化学方程式是_______________________________。
(3)写出离子方程式:
反应①__________________;反应③_____________________。
(4)在熔融条件下电解Q的化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com