
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:分析 根据题意知,电极a、b上没有气体生成,则活性电极Ag作阳极,即a作阳极,b为阴极,所以M为正极,N为负极,c是阳极,d是阴极;
(1)根据以上分析确定M的电极;
(2)电解池阴极上析出银,根据转移电子数计算生成银的质量;
(3)根据生成物与转移电子的关系式计算;
(4)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,据此确定溶液中银离子是否变化;
(5)分析可知电解过程中是电解水,依据溶质不变列式计算.
解答 解:(1)根据题意知,电极a、b上没有气体生成,则活性电极Ag作阳极,即a作阳极,b为阴极,所以M为正极,故答案为:正;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的$\frac{2}{3}$所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:Ag;2.16g;
(3)b电极上的电极反应式为:Ag++e-=Ag
C.电极上的电极反应式为:4OH--4e-=2H2O+O2↑
d.电极上的电极反应式为:2H++2e-=H2↑
假设转移电子的物质的量是2mol,则生成银2mol、生成氧气0.5mol、生成氢气1mol,所以
所以电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:2:$\frac{1}{2}$:1,
故答案为:2;$\frac{1}{2}$;1;
(4)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,所以硝酸银溶液的浓度不变,溶液的pH不变;
故答案为:不变;不变;
(5)设原5.00%的H2SO4溶液为xg,电解消耗水0.01×18=0.18g,则:5.00%x=5.02%(x-0.18),解得:x=45.18g.
故答案为:45.18.
点评 本题以电解池原理为载体考查了物质的量的有关计算、原电池正负极的判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,难度中等,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2 c(Na+) | |
| C. | 硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2 NH4+ | |
| D. | 一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃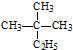 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图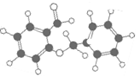 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H+H→H-H | B. | H-C1→H+C1 | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H 2O(g)═H 2(g)+O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
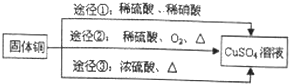
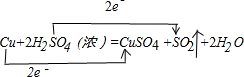 ,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.
,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com