
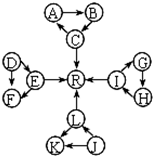
 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):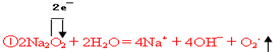 ,
,

科目:高中化学 来源: 题型:
 Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、气体甲的摩尔质量为44 |
| B、沉淀甲是硅酸和硅酸钙的混合物 |
| C、K+、CO32-、A102-和SiO32-一定存在于溶液X中 |
| D、SO42-一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
| D、4(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
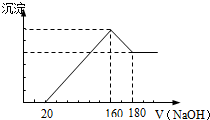 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶 液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)反应过程中涉及的化学方程式
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶 液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)反应过程中涉及的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积减小 |
| B、反应NH3(g)+HCl(g)═NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| 太阳光 |

| nCH3OH |
| nCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、增大密闭容器的容积 |
| C、使用催化剂 |
| D、增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com