
【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动
【答案】D
【解析】
A.不断将氨气液化分离,生成物的浓度减小,平衡正向移动,故正确;
B.压缩体积,平衡正向移动,氮气转化率增大,故正确;
C.前10分钟,N2+3H2 ![]() 2NH3
2NH3
起始 0.5 1.5 0
改变 x 3x 2x
10min时 0.5-x 1.5-3x 2x
有![]() ,解x=0.175mol/L,用氨气表示反应速率为
,解x=0.175mol/L,用氨气表示反应速率为![]() =0.035 mol·L1·min1,故正确;
=0.035 mol·L1·min1,故正确;
D. N2+3H2 ![]() 2NH3
2NH3
起始 0.5 1.5 0
改变 x 3x 2x
平衡 0.5-x 1.5-3x 2x ,有![]() ,解x=0.25mol/L,则平衡常数表示为
,解x=0.25mol/L,则平衡常数表示为![]() ,在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,则有Qc=
,在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,则有Qc=![]() <K,平衡正向移动,故错误。
<K,平衡正向移动,故错误。
故选D。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原子的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
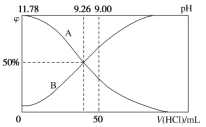
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。

(1)实验证明草酸铵分解产物有:NH3、CO2、CO和水,其中说明分解产物中有CO的实验现象是__。
(2)装置C中发生反应的离子方程式为_____。
Ⅱ.该同学利用草酸铵测定某品牌牛奶中钙的含量,实验步骤如下:
①取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.100mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗KMnO4溶液16.00mL。
已知:H++![]() +H2C2O4——Mn2++CO2+H2O(未配平)
+H2C2O4——Mn2++CO2+H2O(未配平)
(3)计算该品牌牛奶中钙的含量(单位:g·L-1),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、![]() 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、![]() 、Cl、Br、
、Cl、Br、![]() 、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
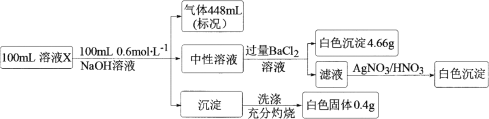
下列说法正确的是
A.溶液X中一定没有![]() 、SiO32-,可能有Na+、Fe2+
、SiO32-,可能有Na+、Fe2+
B.溶液X中加NaOH后,所得沉淀的成分可能有两种
C.溶液X中c(Cl)≤0.2 mol·L1
D.溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二元化合物X可由单质硫和Ca(OH)2浊液共热制得。取一定量X与100 mL 0.2 mol·L1稀硫酸恰好完全反应,生成0.08 mol淡黄色沉淀和0.448 L气体甲(已折算为标准状况)。请回答:
(1) 甲的电子式为________。
(2) X的化学式为________。
(3) X与稀硫酸反应的化学方程式为________。
(4) 单质硫和Ca(OH)2浊液制X时,还生成另一种含氧酸盐(M<160 g·mol 1),该盐与稀硫酸反应也有淡黄色沉淀生成并放出刺激性气味气体,则单质硫与Ca(OH)2浊液反应制X的化学方程式为________。
(5) 气体甲通入硫酸铁溶液中能发生反应。请设计实验方案验证反应后溶液中除H+之外的阳离子________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是
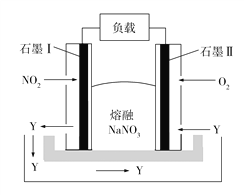
A. 电池工作时,石墨电极Ⅰ上电极反应式为2NO2 2e +O2![]() N2O5
N2O5
B. 电池工作时,![]() 向石墨电极Ⅰ移动
向石墨电极Ⅰ移动
C. 该电池充电时,石墨电极Ⅱ连接电源的负极
D. 电池工作时,外电路中流过1 mol电子,则消耗46 g NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com