
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
分析 A、水杨酸显酸性;
B、蒸馏法、电渗析法、离子交换法是海水淡化的主要方法;
C、漂白粉在空气中变质是因为其有效成分CaClO2会与空气中的CO2、H2O反应生成HClO,HClO分解使漂白粉变质失效;
D、安装煤炭燃烧过程的“固硫”装置,是为了减少硫的化合物的排放.
解答 解:A、水杨酸中含-COOH,显酸性,能与小苏打反应,故能用小苏打解毒,故A正确;
B、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确;
C、漂白粉长期暴露在空气中,其有效成分Ca(ClO)2会与空气中的CO2、H2O反应生成HClO,HClO分解使漂白粉变质失效,故C正确;
D、安装煤炭燃烧过程的“固硫“装置,主要是为了减少污染,而不是提高煤的利用率,故D错误.
故D.
点评 本题考查常见有机物的性质,涉及有机物的官能团的性质、海水的淡化、漂白粉的性质,空气污染等,题目难度不大,注意化学与生产生活的联系.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
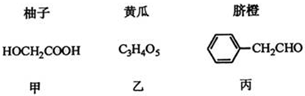
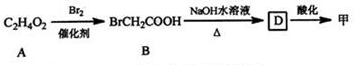
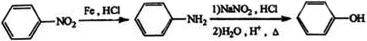
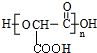 +(n-1)H2O.
+(n-1)H2O.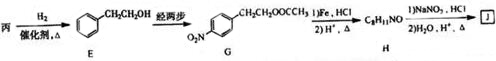
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| B | 将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
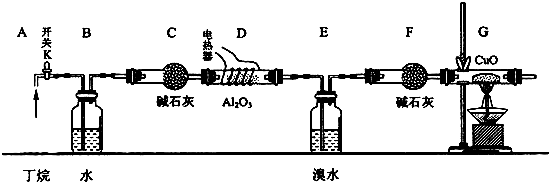
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
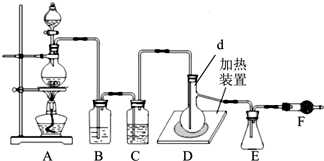
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH) 3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2?Fe(SO2)63+ (反应b) | ⅰ.制备Fe(OH) 3胶体并检验 ⅱ.分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
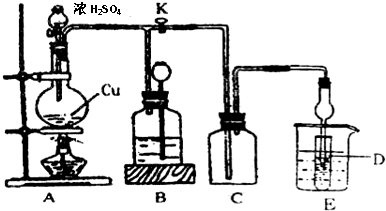
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
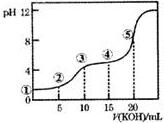 常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | |
| D. | 点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com