
分析 因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2(SO4)3=3FeSO4,根据反应后溶液中亚铁离子的物质的量可知,5.2g固体沉淀物一定有铜,则后发生Fe+CuSO4=FeSO4+Cu,然后根据化学反应方程式列式计算即可.
解答 解:溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<$\frac{6g}{56g/mol}$,说明加入6g铁粉过量,
设硫酸铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2(SO4)3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu 质量增加
1mol 1mol 1mol 1mol 64g-56g=8g
ymol ymol ymol ymol 8yg
则:①3x+y=0.1、②6g-56x+8y=5.2,
解得:x=0.02mol、y=0.04mol,
(1)故得生成铜质量为:0.04mol×64g•mol-1=2.56g,
答:反应后生成铜的质量为2.56g;
(2)原溶液中Fe2(SO4)3物质的量浓度为:$\frac{0.02mol}{0.2L}$=0.1mol/L,
答:原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L.
点评 本题考查混合物反应的计算,题目难度中等,明确氧化性的强弱、反应的先后顺序是解答本题的关键,注意掌握差量法、质量守恒定律在化学计算中的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
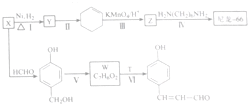

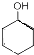 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$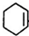 +H2O,反应类型为消去反应
+H2O,反应类型为消去反应 ,反应类型为缩聚反应
,反应类型为缩聚反应 ,T的分子式为C2H4O
,T的分子式为C2H4O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
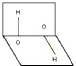
| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com