
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年河北省唐山市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体( Na2Cr2O7·2H2O)的主要工艺流程如下:
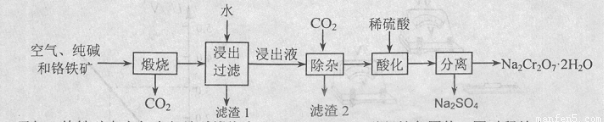
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3  2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为____。
(2)滤渣1的成分为________,滤渣2的成分为____。
(3)将滤渣l放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是??????? 。
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mo1/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀 ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于?????????? mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于?????????? mol/L,后续废水处理方能达到国家排放标准。
②还原法: 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式?????????????????? 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式?????????????????? 。
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是?????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com