
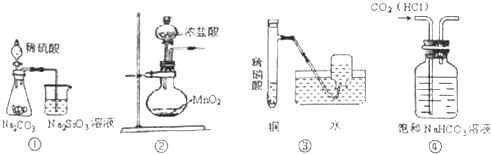
| A. | 图①可证明酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| B. | 图②可用于实验室制备少量氯气 | |
| C. | 图③可用于实验室制备少量NO气体 | |
| D. | 图④可除去CO2中少量HCl气体 |
分析 A.强酸能制取弱酸;
B.浓盐酸与二氧化锰需要加热才反应;
C.稀硝酸和铜反应生成NO;
D.除去CO2中的HCl气体,选择试剂为饱和碳酸氢钠溶液.
解答 解:A.强酸能制取弱酸,酸性:H2SO4>H2CO3>H2SiO3,故A正确;
B.浓盐酸与二氧化锰需要加热才反应,常温下不反应,故B错误;
C.稀硝酸和铜反应生成NO,NO不溶于水,可用排水法收集,故C正确;
D.除去CO2中的HCl气体,选择试剂为饱和碳酸氢钠溶液,HCl与碳酸氢钠反应生成二氧化碳,故D正确.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
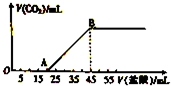 将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
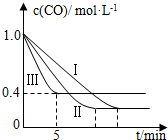 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的链节为
的链节为 .其单体的结构简式分别为
.其单体的结构简式分别为 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰-Ca(OH)2 | B. | 重晶石-BaCO3 | C. | 绿矾-CuSO4•5H2O | D. | 小苏打-NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3通入BaCl2溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将人群向低处疏散 | B. | 将人群逆风向疏散 | ||
| C. | 用浸有水的毛巾捂住口鼻 | D. | 向泄露地点撒一些石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
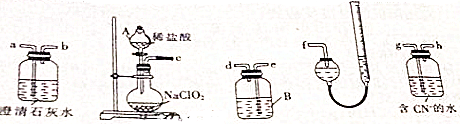

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com