
| A. | 元素Y、W的简单阴离子具有相同的电子层结构 | |
| B. | 由X、W两种元素组成的化合物是离子化合物 | |
| C. | X的简单气态氢化物的热稳定性比W的强是因为X的氢化物分子间易形成氢键 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,Y是迄今发现的非金属性最强的元素,应为F;X原子的最外层有6个电子,且原子序数小于F,应为O元素;在周期表中Z位于IA族,由原子序数关系可知Z为Na元素;W与X属于同一主族,W应为S元素,结合对应物质的性质以及元素周期率知识解答该题.
解答 解:Y是迄今发现的非金属性最强的元素,应为F,X原子的最外层有6个电子,且原子序数小于F,应为O元素,在周期表中Z位于IA族,由原子序数关系可知Z为Na元素,W与X属于同一主族,W应为S元素,
A.元素X、W的简单阴离子分别为O2-、S2-,离子的电子层结构不同,故A错误;
B.X、W分别为O、S元素,二者形成的化合物二氧化硫、三氧化硫都是共价化合物,故B错误;
C.氢键影响熔沸点,而氢化物稳定性与共价键有关,与氢键无关,故C错误;
D.离子核外电子层数越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径大小为:r(Na+)<r(F-)<r(O2-)<r(S2-),即r(Z)<r(Y)<r(X)<r(W),故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 0.1mol氧气参加反应得到电子的数目一定为0.4NA | |
| D. | 常温下,1L0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将22.4 L HCl溶于水配制1 L溶液,其溶质的物质的量浓度为1.0 mol/L | |
| B. | 1 mol/L的Na2CO3溶液中含有2 mol Na+ | |
| C. | 500 mL 0.5 mol/L的(NH4)2SO4溶液中含有NH4+个数为0.5NA(NA为阿伏加德罗常数) | |
| D. | Na+浓度为0.2 mol/L的Na2SO4溶液中SO42-浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,不能证明原溶液中一定有Fe3+,无Fe2+ | |
| B. | 气体通过湿润的红色石蕊试纸,试纸变蓝,证明原气体中一定含有氨气 | |
| C. | 用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中一定有Na+,可能有K+ | |
| D. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氯气反应能形成离子键,故钾与氯气反应也能形成离子键 | |
| B. | 氯气能置换出NaBr溶液中的溴,故F2能置换出NaCl溶液中的氯 | |
| C. | Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O | |
| D. | C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定 条件下反应生 成物质C | ①由C、H两 种元素组成 ②球棍模型为 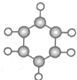 | ①由C、H、O三 种元素组成 ②能与Na反应, 但不能与NaOH 溶液反应 ③能与E反应生成 相对分子质量为 100的酯 | ①相对分子质量 比物质C小2 ②能由物质C氧 化而成 | ①由C、H、O三 种元素组成 ②球棍模型为 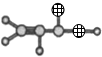 |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com