(2010?启东市模拟)联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020
年,单位GDP二氧化碳排放比2005年下降40%~45%.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
C
C
.(填字母序号)
A.电解水制氢:2H
2O
2H
2↑+O
2↑ B.高温使水分解制氢:2H
2O
2H
2↑+O
2↑
C.太阳光催化分解水制氢:2H
2O
2H
2↑+O
2↑
D.天然气制氢:CH
4+H
2O
CO+3H
2(2)CO
2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,一定条件下发生反应:
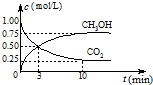
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ/mol,测得CO
2和CH
3OH(g)的浓度随时间变化如图所示.
①从3min到10min,v(H
2)=
0.11
0.11
mol/(L?min).
②能说明上述反应达到平衡状态的是
D
D
(选填编号).
A.反应中CO
2与CH
3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H
2,同时生成1mol H
2O
D.CO
2的体积分数在混合气体中保持不变
③下列措施中能使n (CH
3OH)/n (CO
2)增大的是
CD
CD
(选填编号).
A.升高温度B.恒温恒容充入He(g)
C.将H
2O(g)从体系中分离 D.恒温恒容再充入1mol CO
2和3mol H
2④相同温度下,如果要使氢气的平衡浓度为1mol/L,则起始时应向容器中充入1mol CO
2和
3.58
3.58
mol H
2,平衡时CO
2的转化率为
86.1%
86.1%
.
(参考数据:
=2.64;
=21.166.计算结果请保留3位有效数字.)
(3)CO
2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO
2(g)+6H
2(g)→CH
3OCH
3(g)+3H
2O.有人设想利用二甲醚制作燃料电池,
以KOH溶液做电解质溶液,试写出该电池工作时负极反应的电极反应方程式
C2H6O+16OH--12e-═2CO32-+11H2O
C2H6O+16OH--12e-═2CO32-+11H2O
.




 培优口算题卡系列答案
培优口算题卡系列答案 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)




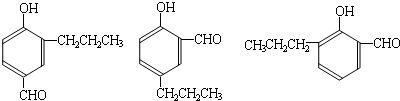

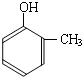 到的合成
到的合成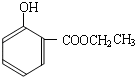 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).
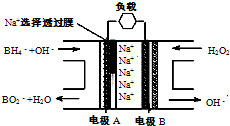 (2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是
(2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是