
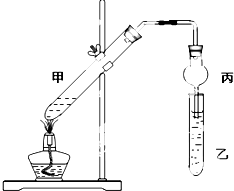
分析 (1)溶液混合时,应该将密度大的液体倒入密度小的液体中;
(2)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯;
(3)浓硫酸做酯化反应的催化剂和吸水剂;
(4)实验室用饱和碳酸钠溶液收集乙酸乙酯;有缓冲作用的装置能防止倒吸;
(5)浓硫酸具有脱水性,能把乙醇脱水生成碳,本身被还原为二氧化硫;
(6)互不相溶的液体可以采用分液方法分离.
解答 解:(1)溶液混合时,应该将密度大的液体倒入密度小的液体中,浓硫酸密度最大、乙醇密度最小,所以试管甲中滴加溶液顺序是:乙醇、浓硫酸、乙酸,且在加浓硫酸时要不断搅拌,防止液体溅出而产生安全事故,故答案为:乙醇、浓硫酸、乙酸;
(2)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)有机化学反应速率较慢,浓硫酸能加快该反应速率而作催化剂,浓硫酸具有吸水性,能吸收酯化反应生成的水而促进平衡正向移动,所以浓硫酸做酯化反应的催化剂和吸水剂,故答案为:催化剂;吸水剂;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,乙醇能溶于饱和碳酸钠溶液,乙酸和碳酸钠反应生成乙酸钠,所以实验室用饱和碳酸钠溶液收集乙酸乙酯;有缓冲作用的装置能防止倒吸,导致的干燥管有缓冲作用,所以能防止倒吸,故答案为:饱和碳酸钠溶液;防倒吸;
(5)浓硫酸具有脱水性,能把乙醇脱水生成碳,本身被还原为二氧化硫,二氧化硫具有刺激性气味,所以观察到反应混合液变黑并闻到刺激性气味,故答案为:温度高时,浓硫酸使乙醇脱水有碳生成,浓硫酸被还原为二氧化硫;
(6)互不相溶的液体可以采用分液方法分离,乙酸乙酯不溶于水,所以可以用分液方法分离乙酸乙酯和水溶液,从而得到乙酸乙酯,故答案为:分液;乙酸乙酯.
点评 本题以乙酸乙酯的制取为载体考查物质制备,侧重考查实验基本操作及物质性质,明确实验原理是解本题关键,注意从实验基本操作规范性及物质性质方面分析评价,题目难度不大.


科目:高中化学 来源: 题型:解答题
| A | ①完全燃烧的产物中n(CO2):n(H2O)=2:1 ②28<M (A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 |
| B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③二溴代物有三种 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证淀粉水解产物时,在淀粉溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量的金属钠 | |
| C. | 向2mLl0%NaOH溶液中滴入2%CuS04溶液的4-6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有砖红色沉淀出现 | |
| D. | 植物油能使溴的四氯化碳溶液褪色,盛过油脂的试管用碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入过量氨水中:SO2+NH3•H2O=NH4++HSO3- | |
| B. | (CH3COO)2Ba溶液中滴入稀硫酸:Ba2++SO42-=BaSO4↓ | |
| C. | 以Ag作电极,电解AgNO3溶液:4Ag++2H2O=4Ag↓+O2↑+4H+ | |
| D. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②⑤ | C. | ②⑤ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com