
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丁、丙 | C. | 甲、乙、丁、丙 | D. | 乙、甲、丙、丁 |
分析 金属能与酸反应放出氢气,说明金属活动性处于H之前;原电池中活泼金属作负极,被腐蚀;金属能与盐溶液反应置换出新的金属,说明新的金属的活动性不如金属活动性强.利用这些变化的规律性,对金属A、B、C、D的活动性进行对比.
解答 解:有甲、乙、丙、丁四种金属,甲、乙能与酸反应放出氢气,丙、丁不能,说明甲乙活泼性大于丙丁;乙能与水反应放出氢气,甲不能,说明金属活泼性甲小于乙;丙、丁用导线相连浸入AgNO3溶液中,丙金属逐渐溶解做原电池负极,说明丙活泼性大于丁,则四种金属的活泼性由强到弱的顺序为:乙、甲、丙、丁,
故选D.
点评 本题主要考查了金属的活泼性强弱的比较、原电池原理分析,题目难度不大,注意比较方法的掌握.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v (C)=0.25 mol•L-1•s-1 | D. | v(D)=0.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A. | 当容器中气体的密度不变时,该反应达到平衡状态 | |
| B. | 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气 | |
| C. | 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L•min) | |
| D. | 容器内达到平衡状态时的压强与起始时的压强之比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
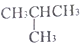
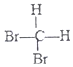 和
和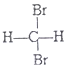
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
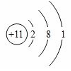 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com