
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
分析 A、二氧化硫和二氧化碳与澄清石灰水反应生成亚硫酸钙,碳酸钙沉淀,溶液变浑浊;
B、硫在氧气中燃烧生成二氧化硫;
C、二氧化硫具有还原性,可以被溴单质,高锰酸钾溶液氧化;
D、盐酸的酸性大于亚硫酸的酸性.
解答 解:A、二氧化硫和二氧化碳都是酸性氧化物,都与澄清石灰水反应生成亚硫酸钙,碳酸钙沉淀,溶液变浑浊,不能用澄清石灰水鉴别SO2和CO2,故A错误;
B、硫在氧气中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫催化剂作用下加热反应生成三氧化硫,故B错误;
C、二氧化硫具有还原性,可以被溴单质、高锰酸钾溶液氧化,使溴水、酸性KMnO4溶液褪色,故C正确;
D、二氧化硫和氯化钙不能发生反应,故D错误;
故选C.
点评 本题考查了二氧化硫的性质分析应用,主要是二氧化硫的氧化性的理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,将粗铜与电源的负极相连 | |
| B. | 合成氨工业中,将NH3及时液化分离有利于加快反应速率 | |
| C. | 氯碱工业中,烧碱在阳极区生成 | |
| D. | 工业上通常使用电解法制备金属钠、镁、铝等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )| A. | pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 | |
| B. | 在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L | |
| C. | 在②点时,溶液中:c(F-)<c(Na+) | |
| D. | 在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
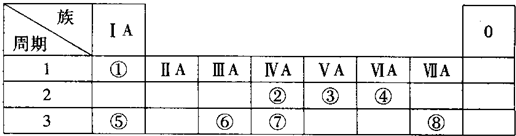
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
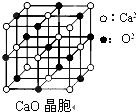 [物质结构与性质]可以由下列反应合成三聚氰胺:
[物质结构与性质]可以由下列反应合成三聚氰胺: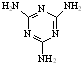 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(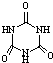 )后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com